
Читайте также:
|
Задача №
1. Уравнение реакции:...................................... ⇄.........................................
реагенты продукты
2. Стандартные энтальпии образования участников реакции при 298 K
| продуктов: | реагентов: |
 (..........) = ………. кДж/моль; (..........) = ………. кДж/моль;
|  (..........) = ………. кДж/моль; (..........) = ………. кДж/моль;
|
 (..........) = ………. кДж/моль; (..........) = ………. кДж/моль;
|  (..........) = ………. кДж/моль. (..........) = ………. кДж/моль.
|
3. Стандартная энтальпия реакции при 298 K:
 =............................................................................................................... =
=............................................................................................................... =
(написать формулу для расчета энтальпии применительно к Вашей реакции)
=.............................................................. =...... кДж/моль... (указать <, >) 0.
(подставить числа)
4. Знак изменения энтальпии объясняется тем, что в ходе реакции теплота …................................................... (указать выделяется, поглощается), реакция является....................................................... (указать экзотермической, эндотермической).
5. Стандартные энтропии участников реакции при 298 K
| продуктов: | реагентов: |
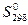 (..........) = ……… Дж/(K·моль); (..........) = ……… Дж/(K·моль);
| 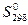 (..........) = ……… Дж/(K·моль); (..........) = ……… Дж/(K·моль);
|
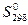 (..........) = ……… Дж/(K·моль); (..........) = ……… Дж/(K·моль);
| 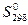 (..........) = ……… Дж/(K·моль). (..........) = ……… Дж/(K·моль).
|
6. Стандартная энтропия реакции при 298 K:
 =..................................................…………………............=.........................................
=..................................................…………………............=.........................................
(написать формулу для расчета энтропии применительно к Вашей реакции)
............................................. = …... Дж/(K·моль) =..... кДж/(K·моль)... (указать <, >, ≈) 0.
(подставить числа)
7. Величина и знак изменения энтропии объясняются тем, что в ходе реакции общее число молекул газов..................... (указать убывает, возрастае т, не изменяется), из..... молекул газов образуется..... молекул газов.
8. Стандартная энергия Гиббса реакции при 298 K:
 =................................................................................................................=
=................................................................................................................=
(написать формулу для расчета этой величины)
=................................................................................=............ кДж/моль.
(подставить числа)
9. Знак энергии Гиббса реакции показывает, что данная реакция при стандартных условиях и 298 K............................................................ (указать возможна, невозможна).
Дата добавления: 2015-07-11; просмотров: 40 | Нарушение авторских прав