
Читайте также:
|
При протекторной защите к металлическому изделию непосредственно или через металлический проводник подсоединяются металл или сплав с более отрицательным значением потенциала, чем потенциал защищаемого изделия. Для железа (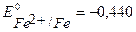 В) в качестве анодного протектора можно использовать магний (
В) в качестве анодного протектора можно использовать магний (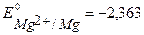 В), цинк (
В), цинк (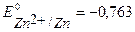 В), алюминий (
В), алюминий (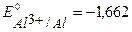 В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как
В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как 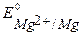 <
< 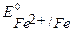 , то в паре с железом магний будет анодом.
, то в паре с железом магний будет анодом.
Согласно уравнению Нернста равновесные потенциалы вероятных окислителей (Н+ и О2) равны:
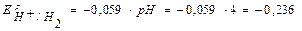 В,
В,
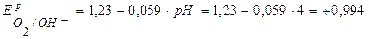 В.
В.
Так как 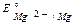 <
< 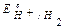 ,
,  , то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
A- : Мg → Мg2+ + 2 
K+ : O2 + 4H+ + 4  → 2H2О
→ 2H2О
2H+ + 2  → H2.
→ H2.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 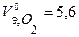 л/моль,
л/моль,  л/моль):
л/моль): 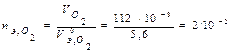 моль-экв,
моль-экв, 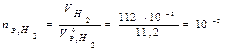 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 3.10-2 моль-эквивалентов окислителя. По закону эквивалентов такое же количество протекторного материала растворилось на аноде: 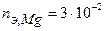 моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния
моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния 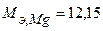 г/моль) равна:
г/моль) равна: 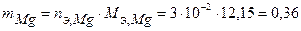 г.
г.
Ø Анодная защита - наложение на конструкцию положительного потенциала и перевод ее в пассивное состояние. Метод применим для металлов, способных пассивироваться. Требует строгого контроля потенциала, что трудно осуществимо на практике.
А: 2Cr + 3H2O – 6e→ Cr2O3 + 6 H+
Электрозащита от коррозии применяется при работе гидростанций, морских портовых устройств и т. д.
3) Изменение свойств коррозионной среды (основной метод в теплоэнергетике)
Ø Уменьшение концентрации коррозионно опасных компонентов ( O2, H+, Cl-, СО2 и др.)
Ø Введение ингибиторов - специальных добавок, замедляющих коррозию.
Ø Уменьшение выбросов в атмосферу ( NOx, SO2, CO2 и др.), осушение воздуха (на адсорбентах).
Уменьшение концентрации кислорода О2:
· деаэрация (кипячение),
· барботаж неактивного газа (N2),
· восстановление с помощью сульфитов, гидразина и др.
O2 + N2H4 = N2 + 2H2O
2Na2SO3 + O2 = 2Na2SO4
Уменьшение концентрации растворенного СО2
(СО2 + Н2О↔Н2СО3↔Н+ +НСО3-):
NH3 + H2CO3 = NH4НСО3
Снижение концентрации ионов Н+:
(гидразин-аммиачный режим ТЭС, рН = 9-9,2; нейтральный режим АЭС)
рН↑ вводя известь CaO +H+→Ca2++ OH-
Снижение общего содержания солей (различные методы водоочистки);
Замена более агрессивных ионов (Cl-) менее агрессивными (NO3-);
Применение ингибиторов:
Ингибиторы – вещества-замедлители коррозии. Ингибиторы:
♦ Жидкофазные применяют в замкнутых системах при V = const.
♦ Газофазные применяют при эксплуатации М на воздухе.
Механизм действия -ингибитор, адсорбируясь на поверхности М тормозит:
- или анодный процесс - анодный ингибитор,
- или катодный процесс – катодный ингибитор,
- или и анодный и катодный процесс - экранирующий ингибитор.
Дата добавления: 2015-07-11; просмотров: 55 | Нарушение авторских прав