
Читайте также:
|
Коррозия - с амопроизвольное и необратимое разрушение металла под действием компонентов окружающей среды - окислителей.
В результате коррозии металл – окисляется, теряет электроны, переходит в форму соединения, а окислители из окружающей среды восстанавливаются, забирают электроны у металла: nM + mOx → MnRedm (1)
Коррозия - процесс самопроизвольный, то есть 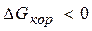 .
.
Для большинства металлов ΔfG0 < 0. В природе металлы встречаются в основном в виде соединений. Процесс получения металлов из соединений, наоборот, вынужденный, требует затраты энергии.
Убытки от коррозии - миллиарды рублей ежегодно (разрушение трубопроводов, цистерн, машин, корпусов судов, морских сооружений и т. п.; безвозвратные потери металлов более 15% от их производства; косвенные убытки часто превышают прямые потери - выход из строя парового котла, обшивки танкера и пр.). Экологический аспект. 2-я половина прошлого века создана теория коррозии, борьба с ней приняла целенаправленный характер.
Классификация коррозии:
(по механизму протекания, по условиям протекания, по характеру разрушения)
1) По механизму протекания:
· Химическая коррозия протекает в неэлектропроводных средах, как гетерогенная окислительно-восстановительная реакция в непроводящих средах.
· Электрохимическая коррозия протекает в электропроводящих средах как электрохимическая реакция.
Химическая коррозия:
а) газовая или высокотемпературная коррозия (ВТК) -в газах и парах при высоких температурах;
б) в неэлектролитах - агрессивных органических жидкостях (сернистая нефть и др.).
Происходит прямое взаимодействие металла с окислителем окружающей среды, непосредственный переход электронов металла на окислитель. Критерий возможности протекания ∆ G < 0
Электрохимическая коррозия:
протекает в средах, имеющих ионную проводимость:
· в электролитах - в водных растворах солей, кислот, щелочей, в морской воде;
· в атмосфере любого влажного газа;
· в почве (в т.ч. коррозия под действием блуждающего тока.
При электрохимической коррозии на энергетически неоднородной металлической поверхности возникают локальные ГЭ: участки с более отрицательными потенциалами оказываются анодами, на них идет анодное растворение М, участки с более положительными потенциалами - катодами, на них идет катодное восстановление окислителя. Процессы разделены пространственно, идут на разных участках поверхности.
Отличие коррозионного ГЭ от обычного: отсутствие внешней цепи, т.е. КГЭ является короткозамкнутым.от обычного явл.нного Г.Э.ьным Е оказываются анодамиозникают локальные Г.
На анодном участке А: M → Mn+(р) + n 
На катодном участке К: Ox + n e = Red
2) По характеру разрушения поверхности
Ø Общая – примерно равномерное разрушение всей поверхности металла
Ø Местная – пятнами, язвами, точечная (питтинг), сосредоточена на отдельных участках, проникает на большую глубину
Ø Межкристаллитная – разрушение по границам зерен металла (где скапливаются примеси)
Ø Избирательная – растворение одного из компонентов сплава (более активного восстановителя)
Дата добавления: 2015-07-11; просмотров: 87 | Нарушение авторских прав