
Читайте также:
|
Как расчетный метод за последние годы очень большое развитие получил второйприближенный метод квантовой химии – метод молекулярных орбиталей (метод МО), основная заслуга в разработке которого принадлежит Хюкелю.
В методе МО π-электроны сопряженной системы рассматриваются как общие для всех углеродных атомов и находящиеся на общих молекулярных орбиталях. Число таких МО равно числу атомов, принимающих участие в образовании сопряженной системы.
МО бывают:
- связывающие МО – энергия электронов на этих орбиталях меньше, чем на атомных, и, следовательно, нахождение электронов на них делает систему более устойчивой;
- несвязывающие МО – энергия электронов на этих орбиталях равна энергии электронов на атомных орбиталях;
- разрыхляющие МО – энергия электронов на этих орбиталях больше, чем на атомных, и поэтому переход электронов на них энергетически невыгоден.
Энергия π-электронов обычно выражается в резонансных интегралах β, численное значение которых определяется опытным путем.
На каждой МО, согласно принципу Паули, может размещаться не более двух электронов с антипараллельными спинами.
Расчет показывает, что в бензоле имеется три связывающие МО и три разрыхляющие МО. Уровни энергии этих орбиталей -2β, -β, -β для связывающих МО и +2β, +β, +β для разрыхляющих МО:
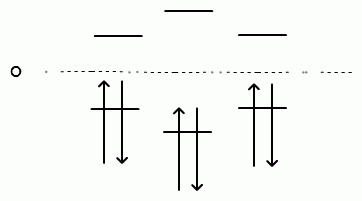
В основном состоянии бензола его шесть π-электронов занимают наиболее выгодные низшие электронные уровни, т. е. три связывающие орбитали.
Таким образом, и приобретение новых электронов и отдача уже имеющихся должны требовать затраты энергии.
В этом отношении π-электронная система бензола подобна электронной оболочке благородных газов.
Дата добавления: 2015-07-12; просмотров: 62 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Метод валентных связей | | | Примеры антиароматических систем |