
Читайте также:
|
ИОННО-КООРДИНАЦИОННАЯ ПОЛИМЕРИЗАЦИЯ
Лучше всего эту проблему рассматривать на примере полимеризации диенов, т.к. в этом случае образуется большой набор структур, которые можно различить различными спектральными методами, например, ИК- и ПМР-спектроскопии.
Итак, при сополимеризации простейшего диена - изопрена

мы можем, в зависимости от природы каталитической системы и условий полимеризации, получить изопрен со следующим набором звеньев
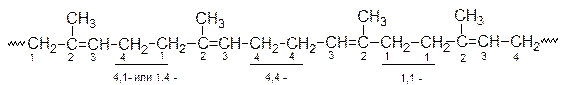
А раз имеется двойная связь, то возможно образование цис- и транс структур:

Возможны (1,2)- и (3,4)- структуры

а также структуры типа “голова - голова”, “хвост - хвост”. Кроме того могут получатся продукты с синдио-, изо- и атактическим распределением боковых заместителей по отношению к главной цепи:
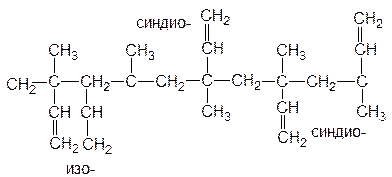
А в случае полимеризации такого прохирального мономера, как пиперилен, возможно и получение полипиперилена, обладающего оптической активностью

Итак, вспомнив о различных микроструктурах полидиенов (т.е. структуре расположения ближайших звеньев макроцепи), перейдем к терминологии.
Почему мы говорим об ионности?
Почему координационность?
Ионность обусловлена тем, что растущая полимерная цепочка (опять-таки в зависимости от каталитической системы и полимеризующегося мономера) имеет заряд. Если полимерная цепочка заряжена мы говорим отрицательно, то мы говорим об анионно-координационной полимеризации, если же положительно - то о катионно-координационном механизме. Второй случай встречается гораздо реже, чем анионно-координационная полимеризация.
Подтверждается механизм использования различных обрывателей. Если типичные радикальные ингибиторы - обрыватели (например, меркаптаны, бензохинон, амины) не обрывают процесс полимеризации, то речь может идти об ионном механизме. А чтобы определить, например, анионная или катионная полимеризация, используют чаще всего меченный тритием метанол. Если образующаяся цепь содержит тритий при введении в процесс полимеризации метанола с меченным тритием по гидроксильной группе, то это анионная полимеризация:

Если использовать метанол, меченный тритием по метоксигруппе, и полимерная цепь содержит меченную метоксильную группу, то мы имеем дело с катионной полимеризаций:
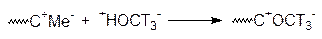
Чем подтверждается координационность процесса?
а) Отбором структур - из двух изомеров может полимеризаваться только один, а второй не может координироваться на активном центре. Это наблюдается чаще всего при полимеризации изомеров пиперилена. Оба этих изомера могут полимеризоваться радикально, но в случае координационной полимеризации расходуется чаще всего транс-изомер пиперилена.
б) Высокой стереорегулярностью образующихся цепей, которая возможна только в результате предварительной соответствующей координации мономера на активном центре.
Так, в случае свободно-радикальной полимеризации изопрена образуется полимер, содержащий 22-25 % 1,4-цис-, 64-67 % 1,4-транс-, и 5 % 1,2- и 5 % 3,4- звеньев (70°С, динитрилазоизомаслянной кислоты CN-C(CH3)2-N=N-C(CH3)2-CN), т.о. в случае полимеризации того же изопрена на неодимовой каталитической системе получается полимер, состоящий почти на 100 % из 1,4-цис-звеньев.
в) Изменением длины связей и валентных углов при координации мономера на активном центре. Есть рентгеновские и спектральные данные подтверждающие это.
Состав каталитических систем
К типично ионно-координационным каталитическим системам или катализаторам Циглера-Натта относят системы, состоящие из катализатора-соединения переходного металла IV-VI-группы (преимущественно галогенида) и сокатализатора - металлоорганического соединения I-III группы (г.о. бутиллитий или триалкилалюминий).
Но это отнесение чисто условное, т.е. имеются сведения об использовании в ионно-координационной полимеризации соединений переходных металлов III группы - лантаноидов и антиноидов и VIII группы - рения, рутения, Co и Ni, а в качестве сокатализаторов - кремнийорганических соединений, т.е. соединений IV группы.
Строение активных центров полимеризации
Со дня открытия катализатора такого типа Циглером в 1954 году и систематического изучения этих катализаторов Натта прошло много лет, но практическое использование катализаторов Циглера-Натта намного опережает достижения в области понимания механизма этого процесса и строения активных центров полимеризации.
И этому есть ряд причин: высокая чувствительность катализаторов Циглера-Натта к малейшим следам примесей и к топологическим характеристикам катализатора, условиям процесса, низкая концентрация и стабильность активных центров полимеризации, гетерогенность катализатора...
Но тем не менее, к настоящему времени сформирован ряд положений, не вызывающих споров у различных исследователей:
а) Считается, что главную, определяющую роль играет соединение переходного металла, а металлоорганические соединения, чаще всего триалкилалюминий, выполняет вспомогательную роль сокатализатора.
Что говорило в пользу этого положения?
1. Известны катализаторы, ведущие полимеризацию без сокатализатора (правда, очень медленно), но нет систем, способных вести полимеризацию в присутствии одного сокатализатора, без катализатора.
2. Стереоспецифичность действия (микроструктура полимера) и константы сополимеризации не зависели в большинстве случаев, от структуры сокатализатора.
Таблица 1
Микроструктура полиизопрена
| Катализатор | Сокатализатор | Содержание звеньев, % | ||
| 1,4-цис- | 1,4-транс- | 3,4- | ||
| TiCl4 | C4H9Li Al(i-C4H9)3 Zn(C4H9)2 | |||
| Ti(OC4H9)3 | C4H9Li Al(i-C4H9)3 | 4-6 1-7 | 94-96 93-99 |
Какую же роль тогда играет сокатализатор? Считается, что сокатализатор:
1. Образует связь переходный металл-углерод, т.к. в качестве соединений переходных металлов используют главным образом стабильные галогениды, т.е. сокатализатор является алкилирующим агентом:
TiCl4 + C4H9Li ® ½C4H9TiCl3½ + LiCl
VOCl3 + AlR3 ® ½RVOCl2½ + AlR2Cl
2. Образующиеся металлорганические соединения переходных металлов высших степеней окисления весьма нестабильны, даже в области невысоких температур, и поэтому происходит востановительное их деалкилирование:
½RTiCl3½ ® TiCl3 + 1/2R-H + 1/2R+H
и, т.о. сокатализатор восстанавливает переходный металл до более низких степеней окисления.
Далее вновь протекает процесс алкилирования и образования связи Ме-С:
TiCl3 + AlR3 (AlR2Cl) ® RTiCl2 + AlR2Cl (AlRCl2)
Металлорганические соединения переходных металлов в восстановленной форме более стабильны, особенно при низких температурах. И вот такое соединение переходного металла, имеющее связи Ме-С и Me-Cl, ведет полимеризацию. Как правило, соединение переходного металла находится в состоянии Ме+3. Об этом свидетельствуют зависимости содержания Ме3+ и выхода полимера от концентрации сокатализатора.


TiCl4-AlR3-изопрен VOCl3-AlR3-пиперилен
Рис. 1.
3. Третья функция, которую выполняет сокатализатор - это функция “санитара” системы. Т.к. сокатализаторы содержат весьма реакционную связь Ме-С (например, Al-C), то они быстро и количественно реагируют с большинством примесей - вода, кислород, полярные примеси, аллены и т.д. Поэтому, если каталитическую систему готовят “in situ”, то сначала в полимеризационную смесь добавляют сокатализатор, а уж затем - катализатор.
4. И наконец, еще одна важная функция, выполняемая сокатализатором, это комплексообразующая функция. Как правило, сокатализаторы - хорошие электроноакцепторы и они способны комплексообразоваться с металлоорганическим соединением, стабилизируя тем самым его.
RTiCl2.AlR2Cl RVCl2.AlR2Cl
И т.о. активные центры, ведущие полимеризацию, включают один металл, а именно переходный. Активные центры, изображенные в виде RMeCln, называются моноиеталлическими. Но чтобы признать роль в ряде случаев алюминийорганического соединения, предполагают, что оно входит во вторую (или более удаленную) координационную сферу переходного металла, и тем самым, не влияя на реакционную способность связи переходный металл - углерод, стабилизирует её:

Примерами каталитических систем, в которых образуются монометаллические активные центры, ведущие полимеризацию диенов, являются системы:
TiCl4-AlR3, VOCl3-AlR3, VOCl3-C4H9Li, Ti(OR’)4-AlR3.
В таких системах алюминийорганическое соединение, действительно, является сокатализатором и не влияет на микроструктуру полидиенов и реакционную способность активных центров, т.е. константу скорости роста, kp (табл. 2).
Таблица 2
| Диен | Соединение переходного металла | AlR3 | Микроструктура полидиенов | kp, л/моль.мин | Са, Моль/моль Me |
| Изопрен | TiCl4 | Al(iC4H9)3
Al(C7H15)3
Al( )3 )3
| 95-96 % 1,4-цис-зв. | 0,4 0,6 | |
| VOCl3 | Al(iC4H9)3
Al( )3 )3
| 83-83 % 1,4-транс-зв. | 3,2 5,3 | ||
| Бутадиен | TiJ2Cl2 | Al(iC4H9)3
Al( )3 )3
| 90-92 % 1,4-цис-зв. | 1,6 4,3 | |
| Ti(OC4H9)4 | Al(iC4H9)3
Al( )3 )3
| 71-73 % 1,2-звеньев | 0,9 1,4 |
Однако природа сокатализатора оказывает очень сильное влияние 1) на скорость процесса (Wп) полимеризации - за счет изменения концентрации активных центров, Са, т.к. в большинстве случаев W = f(kp, Ca) и 2) на молекулярные массы (или [h]) полидиенов за счет разной константы передачи цепи на алюминийорганический сокатализатор, т.е. разного времени жизни активных центров.
Какие характерные особенности лантаноидных каталитических систем?
1. Алюминийорганические соединения не восстанавливают галогениды лантаноидов, и лишь в случае Eu и Sm - катализаторов, которые способны восстанавливаться до Ме2+, полимеризация не протекает.
2. Алюминийорганическое соединение влияет на стереоспецифичность образующихся активных центров, т.к. в зависимости от природы АОС получаются полидиены с различной стереорегулярностью цепей (т.е. микроструктурой).
3.Алюминийорганическое соединение влияет на реакционную способность и концентрацию активных центров и константы сополимеризации диенов.
Таблица 3
Константы сополимеризации бутадиена с изопреном
(NdCl3.3ТБФ-AlR3, толуол, 25°С)
| AlR3 | rб | rи |
| Al(iC4H9)3 Al(iC4H9)2H | 1,3 2,0 | 0,7 0,5 |
Таблица 4
Бутадиен, NdCl3.3ТБФ-AlR3, толуол, 25°С
| AlR3 | Содержание звеньев, % | kp | koM .102 | koAl | Ca, % | ||
| 1,4-цис- | 1,4-транс- | 1,2- | л/моль.мин | ||||
| Al(iC4H9)3 Al(iC4H9)2H Al(C2H5)3 Al(C6H13)3 | 94,5 91,2 89,0 92,1 | 5,0 7,4 10,4 7,3 | 0,5 1,4 0,6 0,6 | - |
Поэтому есть все основания говорить, что в случае лантаноидных каталитических систем, образуются биметаллические активные центры типа:

По какой из двух Ме-С - связей структуры (б) идет внедрение мономера, до сих пор остается дискуссионным вопросом.
И здесь самое место поговорить о лигандном окружении переходного металла в активном центре. И опять это удобно сделать на основе лантаноидных систем.
Растворитель. Оказалось, что природа растворителя, использованного при полимеризации диенов, оказывает влияние на микроструктуру полидиенов и на реакционную способность активных центров (Табл. 5).
Таблица 5
NdCl3.3ТБФ-Al(iC4H9)3, 20°C
| Диен | Растворитель | Содержание цис-звеньев, % | kp, л/(моль.мин) |
| Бутадиен | Толуол Гептан | ||
| Изопрен | Толуол Гептан | ||
| Пиперилен | Толуол Гептан |
Как видно из таблицы 5, содержание цис-звеньев и Кр выше при использовании алифатического растворителя, чем ароматического, за счет образования ареновых комплексов в последнем случае. Зависят от природы растворителя и константы сополимеризации. Кроме того, константа координации растворителя имеет разные значения: Кт в толуоле и гептане сильно различаются.
Поэтому можно считать, что молекула растворителя может входить в состав активных центров полимеризации:

Это связано с тем, что атомы лантаноидов обладают относительно высоким ионным радиусом и имеют большое координационное число, достигающее 8-12.
Полярные соединения, примеси, добавки. Эти молекулы также могут координироваться на активном центре и входить тем самым в их состав. Еще первые данные показали, что Кр при использовании трибутилфосфатных комплексов выше, чем в случае диамилсульфоксидных комплексов хлоридов лантаноидов, хотя стереоспецифичность при полимеризации бутадиена в области умеренных температур практически не меняется (табл. 6). Зависят от природы комплексообразующего лиганда и константы сополимеризации (табл. 7).
Таблица 6
NdCl3.3L-AlR3, толуол, 25°С
| Диен | Кр, л/моль.мин. | |
| ТБФ | ДАСО | |
| Бутадиен Изопрен |
Таблица 7
| L | rб | rи |
| ТБФ ДАСО | 1,3 1,0 | 0,7 1,0 |
И еще одно доказательство того, что комплексообразующий лиганд L входит в состав активных центров полимеризации получен недавно. Так, если использовать в качестве лиганда ТБФ (это оптически неактивное соединение), то образуется и оптически неактивный полипропилен. Если же применять оптически активный сульфоксид или спирт, то образуется полимер, угол которого совпадает по знаку со знаком использованного оптически активного лиганда (табл 8).
Таблица 8
NdCl3.3L*-Al(iC4H9)3, толуол 25°C
| Лиганд | Полипиперилен | ||
| Формула | [a]D20, ° | Содержание цис-звеньев, % | [a]D20, ° |
(С4H9)4PO


| -47 +51 | -2,5 +2,2 |
Как работает активный центр, или иными словами, механизм формирования звеньев различной микроструктуры.
Здесь в настоящее время существуют г.о. два механизма стереорегулирования.
По одному из них, координационному, стереорегулярность образующихся цепей зависит от того, как скоординировался подошедший диен на активном центре. Если активный центр имеет одно вакантное место, то монометр координируется одной двойной связью и поэтому образуются транс-звенья:

Если же на активном центре имеется два вакантных координационных места, то диен может координироваться обеими двойными связями:

Поэтому одни катализаторы ведут транс-полимеризацию диенов (например, VOCl3), а другие - цис-полимеризацию (TiCl4, лантаноидные). Однако согласно этой теории, трудно объяснить формирование цепей с 1,2- или 3,4-звеньями.
Согласно второй теории, развиваемой в СССР академиком Б.А.Долгоплоском, диен всегда координируется двумя двойными связями на переходном металле в активном центре:

p-аллильная форма МОС
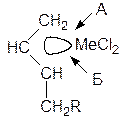
Направление А:

Т.о. при вхождении мономера по направлению А образуются звенья 1,4-структуры.
Если же скоординировавшийся диен входит по направлению Б, то образуются 1,2-звенья:

Но как же образуются 1,4-цис- и 1,4-транс-звенья?
p-алкильный комплекс может существовать в виде двух изомерных структур - анти- и син-форм.

Образование анти- и син-форм активных центров и направление вхождения координированного диена зависят от многих факторов: природы, валентности, переходного металла, его лигандного окружения, аллотропной модификации, прочности и реакционной способности связи Ме-С, условной полимеризации, температуры, природы растворителя, концентрации и строения сокатализатора и ряда других причин.
Таким образом подведем итоги:
1. Валентное состояние переходного металла в каталитической системе, как правило, +3.
2. Необходима связь Ме-С, координация мономера.
3. Биметалличность, вероятно, общее свойство активных центров.
Стадии процесса ионно-координационной полимеризации
Формирование активных центров-образование соединений со связью Ме-С и связи с сокатализатором (комплекс, мостичное строение, куда входит сокатализатор во вторую или более дальнюю координационную сферу)


а) Инициирование-образование соединений активных центров с первой молекулой мономера:

б) Рост цепи:
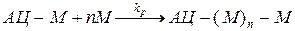
в) Обрыв и передача цепи:

Если АЦ.О не активен, то это истинный обрыв, если активности сравнили то имеет место передача цепи и О-передатчик цепи.
Разберем более подробно эти отдельные стадии.
а) Инициирование состоит, как и стадия роста, из двух стадий - координирования и роста

1-ый порядок по М 0-ой порядок по М
Как же определить k1 - константу координации и константу внедрения kв?
В литературе практически нет данных об этих величинах. Но, к счастью, соединения лантаноидов обладают способностью фотолюминесцировать после облучения их светом определенной длины волны. Облучив активный центр мы получим возбужденный ½АЦ*½. Если теперь к такой системе добавить мономер и следить за тушением фотолюминесценции во времени, то можно определить константу тушения kт, которая тождественна константе координации k1.
 Рис.2.
Рис.2.
Определенные таким образом константы тушения некоторых лантаноидных катализаторов приведены в табл.9.
Таблица 9.
Константы тушения системы
LnCl3.3ДАСО-Al(iC4H9)3, толуол, 25°С.
| Диен | Константа тушения, л/моль.сек. | ||
| Eu | Tb | Dy | |
| Изопрен Транс-пиперилен Бутадиен | 2,6.103 1,1.103 0,7.103 | 2,6.104 - 1,9.104 | 1,0.105 1,4.105 1,1.105 |
Видно, что константы тушения (координации) очень сильно зависят от природы переходного металла и мало от природы диена, хотя также меняются при переходе от одного диена к другому. И ещё: видно, что значения константы координации на 1-3 порядка выше, чем константа скорости роста (kp = 102–103 л/моль.мин). Т.о. следует, что в случае лантаноидных каталитических систем стадия координации не является лимитируещей стадией. А лимитирует процесс – стадия внедрения диена по связи Ме-С.
б) Рост цепи.
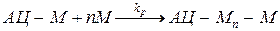
Эксперимент показывает, что как правило реакция роста следует первому порядку по мономеру и активным центрам, т.е. Wп = kp.C1M.C1a, хотя есть и исключения, связанные с диффузионными процессами или лимитирующим внедрением (рис 3)


Рис. 3.
Суммарная энергия активации процесса 4-15 ккал/моль.
Установлено, что kp зависит от природы переходного металла и его лигандного окружения, строения сокатализатора и полимеризующегося диена (обычно Б>И>П) и условий полимеризации (температуры, растворителя, соотношения компонентов, способа приготовления катализатора, введение добавок).
Существуют три наиболее часто применяемых случая оценки значений Кр. Рассмотрим наиболее простой случай, когдаWn
1.Кинетический метод, основанный на уравнениях связывающих изменения молекулярной массы во времени. Оказалось, что Wn = Kp.CM.Ca

где Рп - степень полимеризации (среднечисленная), Wn - скорость полимеризации, Ca - концентрация АЦ, t - время полимеризации, Woj - скорость обрыва на j - компоненте.
В начальный период полимеризации, когда обрывом можно пренебречь, уравнение можно упростить и записать
 или
или 
Если теперь откладывать зависимости 1/Pn от 1/t или Pn от t, то можно определить значения kp (рис. 4).


Рис. 4.



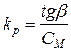

2. Метод ингибирования. Основан на конкурирующей реакции комплексообразования АЦ с мономером и веществом ингибитором, в результате которой доступ диена к активным центрам затруднен и скорость полимеризации падает

Если (2) больше (1), то наступает ингибирование. Ингибиторами (в зависимости от типа каталитической системы и мономера) могут служить такие вещества, как циклопентадиен, трифенилфосфин, окись углерода и др. Откладывая зависимость скорости полимеризации от концентрации ингибитора и экстраполируя значения Wп ® 0, получим концентрацию ингибитора, необходимую для подавления каталитической способности всех активных центров, и тем самым Са:


Обычно концентрация активных центров составляет от десятых долей процента до нескольких процентов от концентрации соединения переходного металла.
3. И, наконец, третий метод – это метод радиационного ингибирования. Считают концентрацию трития, вошедшего в полимер, при ингибировании меченным тритием метанолом
АЦ+ –С~~R + +TOCH3 ® T+ –C~~R
в) Реакции обрыва и передачи цепи
R~~АЦ + М  R~~М + АЦ¢; WoM = koM Ca.CM
R~~М + АЦ¢; WoM = koM Ca.CM
R~~АЦ + AlR3  R~~AlR2 + АЦ--R; WoAl = koAl Ca.CAl
R~~AlR2 + АЦ--R; WoAl = koAl Ca.CAl
R~~АЦ + Пр  R~~АЦ-R; WoПр = koПр Ca.CПр
R~~АЦ-R; WoПр = koПр Ca.CПр
Т.к. стараются очистиь систему хорошо, то 3-ю реакцию, как правило не учитывают. Поэтому степень полимеризации
 ,
,
однако обычно пользуются обратной степенью полимеризации:


Если теперь отложить зависимости  от
от  и СAl, то получим
и СAl, то получим


Рис.5.
Зная kp, можно найти koM и koM.
Как правило, koM/kp» 10-3 ¸ 10-4 и koAl/kp» 10-1 ¸ 10-2
т.е. koAl >> koM, но т.к. СМ >> СAl, то WoAl @ WoM
В табл. 10 приведены koAl и koM для ряда каталитических систем.
Таблица 10
| Каталитическая система | Растворитель | Диен | koAl, л/моль.мин | koM, л/моль.мин |
| NdCl3-Al(iC4H9)3 | Гептан Толуол | Пиперилен | 2,3 1,7 | 7,1 9,4 |
| TiCl4-Al(iC4H9)3 TiJ2Cl2-Al(iC4H9)3 VOCl3-Al(iC4H9)3 | Толуол Толуол Толуол | Изопрен |
Часто надо знать такую характеристику процесса полимеризации, как число макроцепей, приходящихся на 1 активный центр. Для этого надо знать: Pn, Скат, Са, СМ, выход полимера.
Допустим, что исходная концентрация изопрена (М0 = 68) в толуоле 1 моль/л, конверсия 80 %, концентрация титанового катализатора (TiCl4) 0,8.10-3 моль/л, концентрация активных центров в системе 1 % от СTiCl4, т.е. 0,8.10-5 моль/л, среднечисленная молекулярная масса 6,8.105.
Определим сначала число полимерных цепей в системе (N)

Поэтому число полимерных цепей на один активный центр (n)
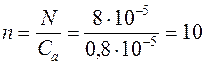
Теперь последнее. Как меняется молекулярная масса и ММР полидиенов при ионно-координационной полимеризации диенов?


Рис. 6.


Рис. 7.

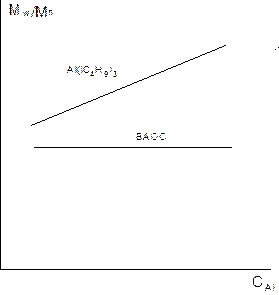
Рис. 8.
 Рис. 9.
Рис. 9.
Как меняется микроструктура?




Дата добавления: 2015-09-01; просмотров: 220 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Нина и заклятье Пернатого Змея 15 страница | | | Теоретические сведения о зубчатых передачах |