
Читайте также:
|
Обмен веществ (метаболизм) – это совокупность всех ферментативных химических реакций, которые могут протекать в клетке. Превращение химических соединений в клетке осуществляется в виде последовательностей реакций, которые называются метаболическими путями, а вовлекаемые в такие реакции соединения – метаболитами. Метаболические пути разделяются на два типа: катаболические и анаболические. Катаболические пути – это процессы ферментативного распада, в ходе которого крупные органические молекулы разрушаются в окислительных реакциях до простых клеточных компонентов с одновременным выделением свободной химической энергии. Анаболические пути – это процессы ферментативного синтеза, в ходе которых из относительно простых предшественников строятся сложные органические молекулы; их синтез часто включает восстановительные этапы и сопровождается затратой свободной химической энергии.
Обмен веществ невозможен без сопутствующего ему обмена энергии. Каждое органическое соединение, входящее в состав живой материи, обладает определенным запасом потенциальной энергии, за счет которой может быть совершена работа. Эту энергию принято называть свободной энергией. Уровни свободной энергии индивидуальных исходных веществ и продуктов реакции, как правило, различны, вследствие чего в процессе преобразования веществ происходит перераспределение свободной энергии между компонентами реакционной смеси, то есть протекает обмен энергией между веществами. Реакции катаболизма энергетически обеспечивают процессы анаболизма. Экзергоническими называются реакции, которые протекают самопроизвольно с выделением энергии и к ним, как правило, относятся катаболические превращения. Эндергонические реакции – это реакции, которые протекают только при поступлении свободной энергии извне, в основном это анаболические процессы.
В наиболее употребительном значении термин «метаболизм» равнозначен обмену веществ и энергии, в более точном и узком смысле метаболизм означает промежуточный обмен, то есть превращение веществ внутри клеток с момента их поступления до образования конечных продуктов. Промежуточный обмен веществ изучает динамическая биохимия.
Метаболизм слагается из сотен различных ферментативных реакций, но центральные метаболические пути немногочисленны и почти у всех живых форм едины.
Практически все метаболические пути осуществляются с помощью мультиферментных систем и могут быть двух типов:
А. Линейный метаболический путь.

Предшественник А превращается в продукт F в результате пять последовательных ферментативных реакций. Продукт одной реакции служит субстратом следующей.
Б. Циклический метаболический путь.
 Именно таким образом происходит окисление ацетильных групп до СО2 и Н2О в цикле лимонной кислоты и образование мочевины в цикле мочевины.
Именно таким образом происходит окисление ацетильных групп до СО2 и Н2О в цикле лимонной кислоты и образование мочевины в цикле мочевины.
Катаболические пути сходятся, образуется лишь небольшое число конечных продуктов.

Катаболический путь и соответствующий ему, но противоположный по направлению анаболический путь между данным предшественником и данным продуктом обычно не совпадают. Могут различаться и промежуточные продукты, и отдельные стадии этих путей. Причины этого:
1) путь, по которому идет расщепление той или иной биомолекулы, может быть непригодным для ее биосинтеза по энергетическим соображениям;
2) необходимость раздельной регуляции процессов биосинтеза и расщепления, часто пути различны по своей локализации.
Общие стадии катаболических и анаболических путей называются амфиболическими.
Пути превращения основных пищевых веществ клетки – углеводов, жиров и белков – называются первичным, или центральным метаболизмом. Вторичный метаболизм – это образование различных специализированных веществ (коферментов, гормонов, нуклеотидов, пигментов, токсинов, антибиотиков, алкалоидов), требующихся клеткам в малых количествах. Во многих случаях эти пути плохо изучены и весьма сложные.
Главными материальными носителями свободной энергии в органических веществах являются химические связи между атомами. При образовании и распаде некоторых связей уровень свободной энергии изменяется в гораздо большей степени, чем при обычной связи. Такие соединения называются высокоэнергетическими соединениями, а связи – макроэргическими. Макроэргическая связь – это связь, при гидролизе или преобразовании иным путем которой, выделяется гораздо больше энергии, чем при гидролизе или преобразовании обычной связи.
Понятие «энергия связи» и «макроэргическая связь» совершенно различны. Первое сводится к характеристике энергетического уровня химической связи с точки зрения физической химии, то есть как величины энергии, необходимой для разрыва связи между атомами. Второе состоит в учете энергетического эффекта в результате преобразования связи посредством химической реакции. Например, энергия химической связи АТФ и глюкозо-6-фосфата примерно одинакова, но при гидролизе в случае АТФ изменение свободной энергии составляет 32,5-34,7 кДж/моль, а в случае глюкозо-6-фосфата – всего 13,1 кДж/моль.
Основные макроэргические соединения:

креатинфосфат (-40,1) уридиндифосфатглюкоза (-28,4)

фосфоенол- карбамоилфосфат 1,3-дифосфогли- ацетилфосфат (-43,7)
пируват (-58,6) (-51,5) церат (-49,1)
 аденозинтрифосфат (-32,5 и -34,7)
аденозинтрифосфат (-32,5 и -34,7)
Макроэргические связи представлены преимущественно сложноэфирными связями, в том числе тиоэфирными, ангидридными и фосфоамидными. Особая роль атомов серы и фосфора в образовании макроэргических связей объясняется следующими причинами:
а) химические связи, свойственные элементам III периода слабее, чем связи, характерные для элементов II периода;
б) сера и фосфор образуют более четырех ковалентных связей;
в) только сера и фосфор среди элементов III периода сохраняют способность к замыканию кратных связей.
С точки зрения квантово-механических представлений для макроэргических соединений характерно накопление положительных зарядов у атомов, непосредственно связанных макроэргической связью, и отрицательных – у окружающих эти связи атомов.
Функции макроэргических соединений:
1) выполняют функцию доноров и акцепторов энергии в обмене веществ;
2) служат аккумуляторами энергии в биохимических процессах;
3) являются трансформаторами энергии, преобразовывают стационарную энергию химической связи в мобильную энергию возбужденной молекулы
Ключевым веществом в энергетическом обмене организма является АТФ. Химическая энергия запасается путем образования АТФ при окислении органических субстратов, а расходуется путем расщепления АТФ в процессах анаболизма. Креатинфосфат, фосфоенолпируват и 1,3-дифосфоглицерат являются АТФ-генерирующими веществами. Почему именно АТФ выпала такая роль? Возможно, это обусловлено ее свойствами:
1. Изменение свободной энергии при гидролизе фосфоангидридных связей довольно велико – около 10 ккал/моль. Когда необходима энергия меньшая или равная 10 ккал/моль, гидролиз идет с отщеплением одной фосфатной группы от АТФ с образованием АДФ. Если необходима энергия ненамного большая, чем 10 ккал/моль, гидролиз идет с отщеплением пирофосфата и образованием АМФ. При необходимости энергии, значительно превышающей 10 ккал/моль, используется несколько молекул АТФ в одном процессе.
2. Скорость неферментативного гидролиза АТФ мала, то есть молекула химически стабильна, и запасенная в ней энергия не рассеивается в виде тепла при спонтанном гидролизе.
3. Малые размеры молекулы АТФ позволяют ей свободно проникать в различные участки клетки, в то время как цитоплазматическая мембрана для нее непроницаема, то есть утечки АТФ из клетки не происходит.
4. Выбор АТФ как нуклеотида был вызван, по-видимому, необходимостью взаимодействия с белками, так как взаимодействие белков с моно- и полинуклеотидами лежит в основе жизнедеятельности.
5. Среди азотистых оснований аденин наиболее устойчив к действию ультрафиолета, что могло иметь значение на ранних этапах формирования живых систем.
Механизм действия АТФ: молекула АТФ осуществляет трансформацию энергии, будучи связана со специфическим белком. Закрепление АТФ на белковой молекуле сопровождается сближением трифосфатной части молекулы с пуриновой ее частью. Выделяющаяся при распаде макроэргической части между вставками фосфорной кислоты энергия передается на пуриновую часть молекулы. Она трансформируется при этом в мобильную энергию возбуждения электронов системы сопряженных двойных связей пуринового цикла, откуда поступает далее к месту химической реакции, переводя в возбужденное состояние электроны преобразуемого органического соединения. Это обеспечивает последнему повышенную реакционную способность, создавая, в частности, потенциальную возможность для обратного преобразования подвижной энергии возбуждения в стационарную энергию новых химических связей.

Химическая энергия, запасенная в форме АТФ, способна производить работу четырех разных видов: 1) биосинтез, 2) сокращение и движение, 3) активный транспорт, 4) передача генетической информации.
Другой путь передачи энергии – через водородные атомы или электроны. Дегидрогеназы отщепляют атомы водорода от молекул клеточного топлива и переносят их на особые коферменты, в частности на окисленную форму НАДФ+. Восстановленная форма этого кофермента НАДФН переносит богатые энергией электроны от катаболических реакций к анаболическим, подобно тому как АТФ переносит высокоэнергетические фосфатные группы. Кроме того, существенной и наиболее древней формой аккумуляции энергии в клетках является трансмембранная разность электрохимических потенциалов, вызываемая в основном ионами Н+ и Na+.
Одно из элементарных фундаментальных свойств живой материи состоит в том, что в системах, обладающих свойствами живого, энергия, необходимая для осуществления химической реакции, при высвобождении в одной точке может быть передана в другую точку, где она непосредственно используется. Это означает, что в живой природе нет необходимости в непосредственном контакте путем соударения молекулы, поставляющей энергию, с молекулой, нуждающейся в энергии. Это принципиально отличает ход химического процесса в живых объектах от такового в неживых.
Клеточный метаболизм основан на принципе максимальной экономии. В организме откладываются жиры и углеводы как источники энергии и углерода, но белки, нуклеиновые кислоты и простые биомолекулы вырабатываются только по мере необходимости и в определенном количестве. Исключение составляют только семена растений и яйцеклетки животных.
Регуляция метаболических путей осуществляется на трех уровнях:
1. Аллостерическая регуляция. Наиболее быстро реагирует на ситуацию. Аллостерический фермент обычно стоит в начале мультиферментной системы и лимитирует скорость всего процесса в целом. Активатором часто служат исходные вещества, ингибитором – конечный продукт. Известны случаи, когда фермент специфическим образом реагирует на промежуточный или конечный продукт других метаболических путей.
2. Индукция ферментов. При накоплении субстрата происходит изменение концентрации данного фермента в клетке. Например, высокая внутриклеточная концентрация субстрата А может стимулировать биосинтез ферментов Е1, Е2, и Е3, в результате чего избыток субстрата А метаболизируется.

3. Гормональная регуляция – свойственна для многоклеточных организмов. Заключается в том, что под влиянием гормонов изменяется или активность фермента, или количество фермента, или проницаемость клетки для субстрата.
Главная задача катаболизма – аккумуляция энергии, полученной в результате окислительно-восстановительных превращений субстратов в такую форму, которая может быть использована для роста клеток и осуществления всех их функций. Совокупность окислительных реакций, происходящих в биологических объектах и обеспечивающих их энергией и метаболитами, называется биологическим окислением.
Окислительно-восстановительными называются реакции, сопровождающиеся переносом электронов от донора к акцептору. Взаимодействующие вещества образуют сопряженные пары, различающиеся числом электронов. Богатый электронами компонент называется восстановленной формой, а бедный электронами – окисленной формой соответствующего соединения. В ходе реакции электроны переносятся с восстановленной формы одной пары на окисленную форму другой пары. При этом восстановитель окисляется, а окислитель восстанавливается.
Направление потока электронов при сопряжении одной окислительно-восстановительной системы с другой определяется их стандартными окислительно-восстановительными потенциалами или редокс-потенциалами Е0. Для любых двух пар система с более положительным значением Е0 будет самопроизвольно стремиться принимать электроны.
Энергетические процессы в организмах подразделяются на аэробные и анаэробные в зависимости от участия в них молекулярного кислорода. Аэробное дыхание – энергетический процесс, при котором конечным акцептором электронов окисляемого субстрата является кислород. В анаэробном дыхании конечными акцепторами электронов становятся другие окислители: нитраты, сульфаты, катионы металлов, органические вещества.
Разнообразные реакции биологического окисления ускоряются многочисленными ферментами, относящимися к классу оксидоредуктаз. Это ферменты, как правило, встроены в биологические мембраны, причем очень часто в виде ансамблей. Классификация процессов биологического окисления и их локализация в клетке:
1. Свободное окисление. Это окисление не связано с образованием АТФ или других макроэргических соединений. При свободном окислении высвобождающаяся энергия переходит в тепловую и рассеивается. Процессы свободного окисления сосредоточены в цитозоле, в мембранах эндоплазматического ретикулума, в мембранах лизосом, пероксисом и аппарата Гольджи, на внешних мембранах митохондрий и хлоропластов.
1) Свободное окисление при участии оксидаз. Оксидазы – ферменты, переносящие электроны на кислород, например, аскорбатоксидаза:

аскорбиновая кислота дегидроаскорбиновая кислота
2) Свободное окисление при участии монооксигеназ. Эти ферменты ускоряют включение в окисляемый субстрат одного атома молекулярного кислорода. Характеризуются коферментами флавиновой природы и требуют участия парного донора, от которого поступают атомы водорода на второй атом молекулярного кислорода. Монооксигеназы принимают большое участие в обезвреживании ксенобиотиков, например, фенолгидроксилаза:

фенол пирокатехин
3) Свободное окисление при участии диоксигеназ. Эти ферменты ускоряют включение в окисляемый субстрат двух атомов молекулярного кислорода. Примером может служить пирокатехаза:

муконовая кислота
Пирокатехаза содержит два прочно связанных атома железа, которые соединяются с молекулярным кислородом в комплекс, где кислород далее активируется. Затем в активном центре пирокатехазы после присоединения субстрата возникает тройной комплекс, образование которого приводит к включению молекулярного кислорода в пирокатехин. Аналогично действуют триптофаноксигеназа, липооксигеназа, каротиноксигеназа. Следующая реакция показывает как из β-каротина с помощью β-каротин-15,15’-оксигеназы образуется ретиналь:
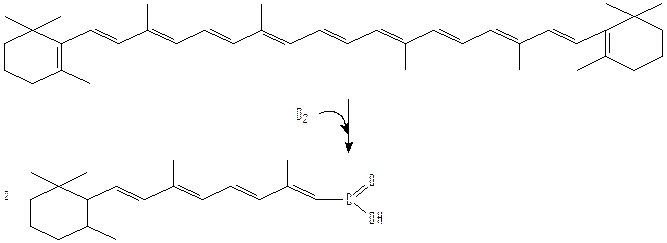
2. Окисление, сопряженное с образованием АТФ.
1) Субстратное фосфорилирование. Это окисление субстрата, приводящее к образованию макроэргической связи, которая затем передается на фосфатный остаток, используемый для фосфорилирования АДФ. Процесс протекает в цитоплазме. Примерами могут служить реакции гликолиза – окисление 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, 2-фосфоглицериновой кислоты – в 2-фосфоенолпировиноградную. Однако посредством реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТФ.
2) Окислительное фосфорилирование. Это сопряжение окисления с синтезом АТФ на уровне электронотранспортной цепи. Атомы водорода с коферментов дегидрогеназ, принимающих участие в окислении субстратов, передаются в оксидоредуктазную цепь, где сопряжено с переносом протонов и электронов на молекулярный кислород происходит активирование неорганического фосфата и фосфорилирование АДФ. Процесс протекает на внутренней мембране митохондрий.
Хемио-осмотическая гипотеза Митчелла: энергия переноса электронов и протонов вдоль дыхательной цепи первоначально сосредоточивается в виде протонного потенциала, или электрохимического градиента протонов, создающегося при их движении через сопрягающую мембрану. Диффузия протонов обратно через мембрану сопряжена с фосфорилированием АДФ при помощи протонной АТФазы.
АТФаза (АТФ-синтетаза) напоминает грибовидное тело и состоит из двух белковых комплексов. Первый из них полностью утоплен в сопрягающую мембрану, состоит из трех видов гидрофобных полипептидных цепей и обозначается Fо. Он представляет собой ионный канал и доставляет протоны из межмембранного пространства ко второму белковому комплексу, плотно к нему прилегающему. Второй комплекс F1 включает в себя пять белков, выступает в матрикс и ответственен за синтез АТФ. В процессе дыхания протоны окисляемого субстрата выбрасываются из мембраны с помощью протонных насосов дыхательной цепи во внешнюю среду (или периплазму) в случае прокариот, или в межмембранное пространство митохондрий в случае эукариот. Поскольку мембрана непроницаема для протонов, их возврат в клетку возможен только через канал АТФазы, при этом АТФаза трансформирует энергию трансмембранного протонного потенциала (protonmotiv force) в АТФ.
Количество энергии, запасенной в форме протонного потенциала (ΔμН+), прямо пропорционально количеству транслоцированных протонов: ΔG=nΔμН+ и складывается из двух составляющих: химической (градиента рН, ΔрН) и электрической (разности электрических потенциалов, Δφ):
ΔμН+/F=Δp=Δφ-2,3(RT/F)ΔpH (мВ), где 2,3(RT/F)=59 мВ при 25оС,
Δp – протондвижущая сила (pmf),
ΔpH=рНout-pHin<0.
Для образования АТФ необходима ΔG около 250 мВ (перенос двух протонов). Примерно такая величина протонного потенциала и создается на мембранах митохондрий и прокариотических клеток, хотя вклад каждой из составляющих различен. Например, у ацидофильных бактерий трансмембранный протонный потенциал практически полностью состоит из ΔpH, а у алкалофилов – из Δφ (из-за того, что внутриклеточный рН постоянен и не очень сильно отклоняется от 7). Важно отметить, что АТФазный комплекс может не только утилизовать трансмембранный протонный потенциал с образованием АТФ, но и формировать его за счет гидролиза АТФ, осуществляя таким образом взаимное превращение этих двух форм энергии.
Кроме биосинтеза АТФ трансмембранный потенциал протонов, возникающий на сопрягающей мембране, является источником энергии для механической работы, поддержания осмотического давления, переноса веществ против градиента концентрации, теплопродукции и других процессов. Это наводит на мысль, что возникновение трансмембранного протонного потенциала на сопрягающей мембране есть универсальный способ запасания энергии в клетке, предшествовавший ее консервированию в макроэргических связях АТФ. По энергезированной мембране гигантской разветвленной митохондрии этот потенциал может передаваться на значительные расстояния для того, чтобы в нужном месте обеспечить синтез необходимого количества АТФ или выполнить иные функции, присущие мембранному электрохимическому потенциалу.
3) Фотосинтетическое фосфорилирование. Это сопряжение окисления воды или других доноров электронов с синтезом АТФ на уровне электронотранспортной цепи внутренней мембраны хлоропластов за счет энергии света.
Пути потребления кислорода в реакциях биологического окисления:
1) Оксидазный – продуктами его являются окисленный субстрат и вода. Эти реакции локализованы в дыхательной цепи и выполняют энергетическую функцию:
SH2 + 1/2O2 → S + H2O
2) Пероксидазный – продуктами являются окисленный субстрат и перекись водорода. Эти реакции протекают в пероксисомах растений, макрофагах и нейтрофилах и осуществляют окисление растворимых веществ:
SH2 + O2 → S + H2O2
3) Оксигеназный – продуктами являются окисленные природные органические вещества в ходе синтеза желчных кислот, стероидных гормонов из холестерина, а также обезвреживание ксенобиотиков, Эти реакции протекают на эндоплазматическом ретикулуме и осуществляют окисление липофильных соединений:
AH2 + S + O2 → A + SO + H2O (для монооксигеназ),
S + O2 → SO2 (для диоксигеназ)
4) Перекисное окисление ненасыщенных жирных кислот – продуктами являются гидроперекиси липидов, спирты, альдегиды, кетоны, диальдегиды, эпоксиды. Эти реакции протекают на мембранах и осуществляют обновление и распад ненасыщенных структурных липидов:
RH + O2 → ROOH.
Дата добавления: 2015-09-05; просмотров: 57 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Как пользоваться дневником | | | Принципы фон Неймана |