
Читайте также:
|
Морфологическое исследование мазков крови включает следующие этапы: подготовку стекол, приготовление мазков, фиксацию мазков, микроскопическую, морфологическую оценку мазков.
Подготовка предметных стекол. Предметные стекла должны быть чистыми, обезжиренными и сухими. Предметные стекла, бывшие в употреблении, очищают механически и кипятят в мыльной воде или воде с содой. Потом моют в водопроводной и дистиллированной воде, высушивают и помещают в банку с эфиром с притертой пробкой. Предметные стекла обезжиривают в смеси Никифорова (этиловый спирт 96% и диэтиловый эфир в соотношении 1:1), после чего их протирают насухо чистой тканью и помещают для хранения в посуду с крышкой.
Мазки лучше готовить из свежей крови, но можно также использовать нитратную и оксалатную в течение 6 ч, гепаринизированную — в течение 24 ч.
Техника приготовления мазка. Мазок крови готовят на предварительно подготовленном обезжиренном предметном стекле (последний берут за ребра, а не за поверхность). На стекло наносят небольшую каплю крови, отступив на 1,5— 2 см от узкого конца. Для размазывания капли берут шлифованное стекло несколько уже, чем предметное, на которое нанесена капля крови. Шлифованное стекло узким краем ставят под углом 45° слева от капли, слегка подвигают его вправо для соприкосновения с ней (выжидают, пока капля не расплывется по всему ребру) и легким быстрым движением ведут стекло справа налево (рис.1). При медленном размазывании ухудшается равномерность распределения форменных элементов в мазке. При нажимании одного стекла на другое многие клетки оказываются поврежденными. Если угол между стеклами меньше 45°, то большое количество клеток скапливается в конце мазка. Величина капли должна быть соразмерна так, чтобы весь мазок помещался на стекле, не доходя на 1 —1,5 см до его конца.
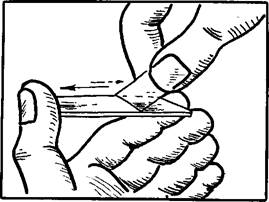
Рис 1. Приготовление мазка крови.
Хорошо приготовленный мазок должен быть ровным, клеточные элементы располагаться в один слой. Он желтоватый, просвечивается и отливает цветами радуги. Густо-розоватые и красноватые мазки непригодны для счета, так как лейкоциты в них деформированы, а эритроциты лежат один на другом (рис.2). Если была взята слишком большая капля, то после того, как она распределилась по ребру шлифованного стекла, последнее приподнимают, переносят на несколько миллиметров влево, вновь ставят на предметное стекло и отсюда начинают делать мазок.
По ширине мазок крови должен не доходить 1,5—2 мм до краев стекла и занимать 2/3—3/4 его длины, заканчиваться «метелочкой».

Рис. 2. Правильно и неправильно приготовленные мазки:
1 — мазок на плохо обезжиренном стекле; 2 —слишком короткий мазок; 3 — слишком длинный неравномерный мазок; 4—слишком толстый мазок; 5—правильный мазок, тонкий, равномерный и достаточно длинный.
Чтобы клетки крови хорошо сохранились, приготовленные мазки необходимо быстро высушить на воздухе, в термостатах, высоко над пламенем горелки, а также на подогретых предметах. В холодное время не следует допускать конденсации паров на мазке, что приводит к сильному гемолизу части эритроцитов. Летом приготовленные мазки защищают от мух, для чего предметные стекла укладывают на опоры мазком вниз.
На высушенном мазке в начальной его части пишут номер животного и дату. Мазки складывают тыльными сторонами попарно и заворачивают в бумагу.
Фиксация мазков. Принцип. Фиксирующая жидкость вызывает коагуляцию белка и прикрепляет клетки к стеклу. Фиксация придает форменным элементам стойкость по отношению к содержащейся в краске воде и препятствует деформации эритроцитов и лейкоцитов.
Реактивы. Метиловый спирт (х. ч.), или этиловый спирт 96%.
Оборудование. Штатив для сушки мазков; пинцет; широкогорлая банка с притертой пробкой или крышкой.
Методика. Высохшие на воздухе мазки опускают в широкогорлую банку с крышкой, выдерживают их в фиксаторе 5—10 мин, а затем извлекают пинцетом и высушивают на воздухе. В этиловом спирте мазки держат не менее 35 мин.
Окраска мазков. Принцип. В строго нейтральной среде структурные элементы клеток крови в азур-эозиновой смеси окрашиваются в различные цвета. Щелочные компоненты клетки (цитоплазма) красятся эозином в розово-красный цвет, кислые (РНК в ядрышках и цитоплазме, ДНК в ядре) основными красителями— в голубовато-синие цвета. Для приготовления красителей и смывания их с мазков используют воду нейтральной реакции. Вода кислой реакции ослабляет действие щелочного элемента красителя (азура II), из-за чего лейкоциты плохо окрашиваются, мазки приобретают цвет эритроцитов (красный) и ядер лейкоцитов. Вода щелочной реакции ослабляет действие кислого компонента красителя (эозина), поэтому эритроциты окрашиваются в серовато-синий цвет, а ядра лейкоцитов становятся темными. Для подщелачивания и доведения воды до нейтральной реакции к ней по каплям прибавляют 1%-ный раствор натрия двууглекислого. Для нейтрализации щелочной воды добавляют 1%-ный раствор уксусной кислоты. Можно брать дистиллированную и водопроводную воду в различных сочетаниях. Реакцию воды определяют с помощью рН-метра или гематоксилина. При использовании гематоксилина к 10 мл дистиллированной воды добавляют 2—3 капли свежеприготовленного спиртового раствора гематоксилина. Вода нейтральной реакции окрашивается в бледно-фиолетовый цвет через 1—5 мин. Если окрашивание воды произошло раньше 1 мин, то она щелочная, а если позже 5 мин — кислая.
Специальное оборудование. Контейнеры для окраски мазков с кюветами.
Окраска по Романовскому — Гимзе. Реактивы. 1. Готовый продажный краситель Романовского — Гимзы (азур-эозиновая смесь). 2. Рабочий раствор (2 капли красителя на 1 мл дистиллированной воды) готовят перед употреблением.
Окрашивание. Фиксированные мазки в кювете заливают рабочим раствором красителя Романовского — Гимзы и выдерживают 15—30 мин. Затем мазки промывают дистиллированной водой и высушивают на воздухе. Продолжительность окраски зависит от качества красителя и температуры воздуха. Чем ниже температура воздуха, тем продолжительнее окраска. Выбор оптимального времени окраски проводят каждый раз, когда начинают использовать новый флакон заводского красителя. Хорошо окрашенные мазки имеют розово-фиолетовый цвет, недокрашенные — розово-красноватый, перекрашенные — темно-фиолетовый.
Микроскопическое исследование мазков крови. Реактивы. Иммерсионное масло, диэтиловый эфир или этиловый спирт.
Оборудование. Микроскоп; 11-клавишный счетчик для выведения лейкоцитарной формулы.
Методика. Просматривают мазок крови под малым увеличением. Подсчет лейкоцитов и оценка морфологии эритроцитов допустимы только в тонкой части мазка, где эритроциты лежат одиночно, а не сложены в «монетные столбики».
На четыре краевых участка мазка наносят по капле иммерсионного масла. Один из краевых участков устанавливают в поле зрения. Подсчитывают лейкоциты способом меандров в четырех условных зонах (рис.3). В каждой зоне надо сосчитать 25% клеток от требуемого количества (100 или 200). Подсчитывают только целые, неразрушенные клетки. Перемещают мазок в зоне таким образом, чтобы, продвинувшись на 3—4 ноля зрения в глубину мазка, поменять направление приблизительно на два поля зрения в сторону по длине препарата, а затем снова возвращаются к краю мазка. Дойдя до края, снова передвигают его на два поля зрения в сторону по длине препарата, затем возвращаются опять в глубину мазка и т. д.
Насчитав 25 (50) клеток белой крови, исследуют второй участок мазка, затем третий и четвертый. Такая методика счета исключает случайные ошибки, связанные с неравномерностью распределения различных форм по мазку.
Найденные и идентифицированные клетки регистрируют с помощью 11-клавишного механизма счетчика, что значительно облегчает и ускоряет исследование.

Рис.3. Подсчёт лейкоцитов способом меандров в четырёх условных зонах мазка.
Оценка результатов. В нормальной крови выявляют следующие формы лейкоцитов: базофилы, зозинофилы, нейтрофилы (палочко- и сегментоядерные), лимфоциты, моноциты. При наличии в мазках крови плазматических клеток, незрелых и труднодифференцируемых форм лейкоцитов их также вводят в лейкограмму.
Одновременно с выведением лейкограммы проводят оценку морфологии эритроцитов. Если в анализе крови не было выявлено отклонений от нормы в количественном составе форменных элементов крови, а при подсчете первых 100 лейкоцитов не обнаружено никаких отклонений от нормы ни в лейкограмме, ни в морфологии лейкоцитов, то можно ограничиться подсчетом этого количества клеток. Если отмечены какие-либо отклонения от нормы, подсчитывают не менее 200 лейкоцитов.
Клиническое значение показателей лейкограммы. При оценке результатов исследования лейкоцитов учитывают общее количество их в 1 мкл крови, наличие ядерного сдвига нейтрофилов, процентное соотношение отдельных видов лейкоцитов, наличие или отсутствие дегенеративных изменений в клетках.
Появление в лейкограмме молодых и дегенеративных форм нейтрофилов (ядерный сдвиг нейтрофилов) свойственно инфекционным и воспалительным процессам, злокачественным новообразованиям, интоксикациям. Различают регенеративный, дегенеративный и лейкемоидный ядерный сдвиг. При регенеративном сдвиге увеличивается содержание палочкоядерных и юных нейтрофилов, при дегенеративном – только палочко- и сегментоядерных нейтргофилов наряду с дегенеративными изменениями в клетках. При лейкемоидном сдвиге появляются более незрелые формы (миелоциты, промиелоциты, миелобласты0. Регенеративнывй сдвиг наблюдается главным образом при воспалительных и гнойно-септических процессах. Дегенеративный сдвиг – показатель функционального угнетения костного мозга, встречается при интоксикациях (сальмонеллез, острый перитонит, уремическая и диабетическая кома).
При анализе мазков крови, во время подсчета лейкограммы, обращают внимание на морфологические особенности лейкоцитов.
Патологические формы нейтрофилов могут быть выражены гиперсегментацией ядер, при которой большинство из них состоит из 4—5 и более сегментов. Гиперсегментация ядер часто сочетается с макроцитозом нейтрофильных лейкоцитов. В нейтрофилах обнаруживают также токсическую зернистость протоплазмы, вакуолизацию цитоплазмы и ядра, пикноз (сморщивание) и гипо-хроматоз ядер, наличие в протоплазме базофильной пунктации — телец Князькова—Деле. Иногда можно встретить распадающиеся клетки (цитолиз) или распадающиеся ядра (кариорексис), ядерные сегменты, не связанные между собой мостками.
Патологически измененные формы эозинофилов отличаются от нормальных неравномерным распределением хроматина в ядре, его гиперсегментацией, наличием в цитоплазме овальных гранул или гранул, окрашенных в красно-фиолетовый цвет.
Патологические формы лимфоцитов характеризуются вакуолизацией протоплазмы, неравномерным окрашиванием ядер, разрыхленностью их субстанции.
Патологическим формам моноцитов свойственны диффузное серое, с желтоватым оттенком окрашивание протоплазмы, наличие в ней вакуолей, полиморфное разрыхленное ядро со слабоокрашенными или неокрашенными участками.
Определение лейкоцитарного профиля. Подсчитав число лейкоцитов в 1 мкл крови у контрольного и подопытного кроликов, и зная процентное соотношение элементов белой крови (лейкоцитарная формула), высчитывают их абсолютное количество в заданном объеме. Например, у контрольного кролика в 1 мкл найдено 6500 лейкоцитов, лейкоцитарная формула выведена в следующем виде (%): Б — 1, Э — 2, П — 7, С — 36, Л - 52, М — 2. Принимая общее число лейкоцитов за 100 %, находим, что в 1 мкл крови базофилов будет 65, эозинофилов—130, палочкоядерных нейтрофилов—455, сегментоядерных нейтрофилов — 2340, лимфоцитов —3380, моноцитов — 130.
Определение индекса регенерации (ядерного сдвига). Этот показатель представляет собой отношение суммы молодых форм нейтрофилов к зрелым.
Вычисляют индекс по формуле: (%М+ %Ю +%П) делим % С
По индексу регенерации можно судить о возрастном составе нейтрофилов. Увеличение этого показателя свидетельствует об активации миелопоэза, снижении его ингибиции.
Таблица 1
Дата добавления: 2015-08-20; просмотров: 273 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Работа 1. Подсчет лейкоцитов в камере | | | Работа 3. Выведение и оценка лейкограмм у животных, больных лейкозом. |