
Читайте также:
|
Вода – термически устойчивое вещество. Она выдерживает нагревание до температуры 1000 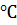 и лишь при температуре свыше 1000
и лишь при температуре свыше 1000 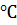 частично разлагается на водород и кислород:
частично разлагается на водород и кислород:
2 Н2О  2Н2 + О2 (2)
2Н2 + О2 (2)
Термическое разложение (иначе термическая диссоциация) воды протекает с поглощением теплоты, а поэтому, согласно принципу Ле Шателье, чем выше температура, тем больше степень диссоциации. Но все же она очень мала и даже при 2000 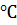 составляет не более 2% [4].
составляет не более 2% [4].
Вода – весьма реакционное способное вещество. Она реагирует с оксидами многих металлов (Na2O, CaO и др.) и неметаллов (Cl2O, [Al2(SO4)3  18 H2O]), вступает во взаимодействие с активными металлами (Na, K и др.).
18 H2O]), вступает во взаимодействие с активными металлами (Na, K и др.).
Вода – катализатор многих химических реакций, и иногда для прохождения реакции необходимы хотя бы ее следы. Так, следы воды нужны для взаимодействия натрия с кислородом в атмосфере воздуха, для реакции фтористого водорода со стеклом и хлора с металлами.
С веществами реакционно малоспособными, находящимися обычно в газообразном состоянии, вода образует ряд интересных соединений. Молекулы газообразного вещества проникают в пустоты структуры ассоциатов воды и образуют соединения, называемые соединениями включения или клатратами. Такие соединения неустойчивы и легко разлагаются при повышении температуры. Примеры клатратов являются СН4  6 Н2О, С2Н5Cl
6 Н2О, С2Н5Cl  15 Н2О и др.
15 Н2О и др.
Тяжелая вода D2О по своим химическим свойствам заметно отличается от обычной воды. Реакции с тяжелой водой, как правило, протекают медленее [4].
Таблица 5 – Химические свойства воды [15]
| С простыми веществами |
1) 1) с металлами:
активный металл* + вода = щелочь + водород
2Na + 2H2O = 2NaOH + H2  металл средней активности** + вода = оксид металла + водород (только при нагревании)
Zn + H2O = ZnO + H2
металл средней активности** + вода = оксид металла + водород (только при нагревании)
Zn + H2O = ZnO + H2  2) 2) с галогенами:(продукты различны)
4F2 + 3H2O = OF2 + 6HF + O2
2) 2) с галогенами:(продукты различны)
4F2 + 3H2O = OF2 + 6HF + O2  Cl2 + H2O = HClO + HCl
Cl2 + H2O = HClO + HCl
|
| Со сложными веществами |
1) 1) оксидами:
оксид активного металла + вода = щелочь
СаО + H2O = Са(ОН)2
кислотный оксид + вода = кислота (кроме SiO2)
SO3 + H2O = H2SO4
2) 2) c солями: образование кристаллогидратов
CuSO4 + 5H2O = CuSO4  5H2O
бледно-голубой ярко-синий
3) 3) с гидридами активных металлов:
гидрид металла + вода = щелочь + водород
КН + H2O = КОН + Н2 5H2O
бледно-голубой ярко-синий
3) 3) с гидридами активных металлов:
гидрид металла + вода = щелочь + водород
КН + H2O = КОН + Н2
|
| *активные металлы – стоящие в ряду напряжений металлов до Mg включительно; **средней активности металлы – стоящие в ряду напряжений металлов от Mg до Pb |
Дата добавления: 2015-08-20; просмотров: 59 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Физические свойства воды | | | Вода – среда жизни |