
Читайте также:
|
Чистая природная вода – жидкость без запаха, вкуса и цвета (лишь в слое толщиной более 2 м голубоватая). Основные физические характеристики воды (при давлении 0,1 МПа) приведены в таблице 1.
Таблица 1 – Основные физические характеристики воды (при давлении 0,1 МПа) [4]
| Константа | Значение |
| Температура: | замерзания, плавления – 0 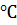 кипения – 100
кипения – 100 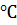
|
| Плотность при: | 0 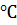 – 0,99984 г/см3
3,98 – 0,99984 г/см3
3,98 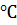 – 0,99997 г/см3
20 – 0,99997 г/см3
20 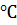 – 0,9982 г/см3
100 – 0,9982 г/см3
100 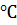 – 0,95835 г/см3 – 0,95835 г/см3
|
| Скрытая теплота: | плавления льда – 330 кДж/кг
испарения при  - 2250 кДж/кг - 2250 кДж/кг
|
| Удельная теплоемкость: | льда -  2,035 Дж/(г 2,035 Дж/(г  К)
воды при К)
воды при 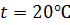 - 4,178 Дж/(г - 4,178 Дж/(г  К) К)
|
Теплопроводность при 
| 4,18 Вт/(м  К) К)
|
| Вязкость при: | 0 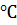 – 0,001793 Па – 0,001793 Па  с
25 с
25 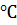 – 0,000895 Па – 0,000895 Па  с с
|
Удельная электростатическая проводимость при 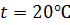
| 4,2  10-6 см/м 10-6 см/м
|
Относительная диэлектрическая постоянная при 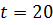
| |
Поверхностное натяжение при 
| 73  10-3 Н/м 10-3 Н/м
|
| Критические константы: | температура – 374,2 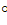 С
давление – 22,12 МПа
плотность – 0,324 кг/л С
давление – 22,12 МПа
плотность – 0,324 кг/л
|
По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств – плотности, удельной теплоемкости, вязкости и др.
При нагревании воды происходит разрыв водородных связей и уменьшается степень ассоциации молекул воды. В интервале температур от 0 до 4 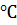 увеличение плотности, вследствие повышения плотности упаковки молекул, преобладает над тепловым расширением и при температуре 3,98
увеличение плотности, вследствие повышения плотности упаковки молекул, преобладает над тепловым расширением и при температуре 3,98 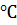 вода имеет максимальную плотность. При дальнейшем нагревании от 4 до 100
вода имеет максимальную плотность. При дальнейшем нагревании от 4 до 100 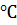 наблюдается нормальное снижение плотности воды. Эта аномалия обуславливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), то он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. При дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4
наблюдается нормальное снижение плотности воды. Эта аномалия обуславливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), то он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. При дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4 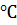 , что позволяет водным организмам, включая ихтиофауну, сохранить жизнь.
, что позволяет водным организмам, включая ихтиофауну, сохранить жизнь.
Большое значение в жизни природы имеет также и тот факт, что вода обладает аномально высокой теплоемкостью – 4,18 Дж/(г  К). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на земле.
К). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на земле.
Еще одна аномалия заключается в том, что при увеличении давления температура плавления льда не повышается, а понижается. Если же после замерзания давление превышает определенную величину, то образуются другие модификации льда, плотнее обычного и даже обычно плотнее жидкой воды. Поэтому плотно закрытый сосуд с замерзшей в нем водой не разорвется, если перед замерзанием вода уже находилась под высоким давлением [4].
Давление паров воды 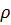 в зависимости от температуры имеет следующие значения:
в зависимости от температуры имеет следующие значения:
Таблица 2 – Зависимость давления паров воды от температуры
t, 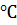
| ||||||
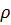 , кПа , кПа
| 0,61 | 2,33 | 7,39 | 19,9 | 47,3 | 101,3 |
Температура кипения воды находится в прямой зависимости от давления – чем она выше, тем выше температура кипения.
Таблица 3 – Зависимость температуры кипения воды от давления [4]
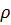 ,кПа ,кПа
| 7,5 | 7,6 | 7,7 | 7,8 | 7,9 | |||
t, 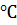
| 93,48 | 97,71 | 99,63 | 100,39 | 100,73 | 101,09 | 101,45 |
Вязкость (способность жидкости оказывать сопротивление различным формам движения) воды закономерно изменяется в зависимости от температуры: уменьшается с ее возрастанием. С повышением концентрации растворенных в воде солей вязкость увеличивается. В то же время действие давления на вязкость воды довольно специфично: с понижением температуры при умеренном давлении вязкость воды снижается, хотя логично было бы ожидать ее повышения, а если давление увеличить значительно, то поведение воды подчиняется общему правилу.
Поверхностное натяжение воды с увеличением температуры уменьшается: при  оно составляет 73
оно составляет 73  10-3 Н/м, а при
10-3 Н/м, а при  - 52,5
- 52,5  10-3 Н/м. При добавлении солей поверхностное натяжение воды возрастает, но незначительно. Поверхностно-активные вещества (ПАВ) обладают способностью сильно снижать поверхностное натяжение.
10-3 Н/м. При добавлении солей поверхностное натяжение воды возрастает, но незначительно. Поверхностно-активные вещества (ПАВ) обладают способностью сильно снижать поверхностное натяжение.
Вследствие асимметричного строения молекула воды обладает резко выраженным дипольным характером, т.е. в молекуле не совпадают центры тяжести положительных и отрицательных зарядов. Дипольный характер молекул воды способствует образованию так называемых продуктов присоединения: к молекулам воды присоединяются молекулы веществ ионного строения или же не иного, но с выраженным дипольным характером [4].
Относительная диэлектрическая постоянная  воды равна 80 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
воды равна 80 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
Оптические свойства воды оцениваются по ее прозрачности, которая, в свою очередь, зависит от длины волны луча, проходящего через воду. Ультрафиолетовые лучи легко проходят через воду, а инфракрасные проникают только в поверхностный слой и в незначительной степени. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску.
Тяжелая вода D2O по своим физическим свойствам отличается от обычной: некоторые константы обычной и тяжелой воды приведены в таблице 4.
Таблица 4 – Константы обычной и тяжелой воды [4]
Дата добавления: 2015-08-20; просмотров: 125 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Строение воды | | | Химические свойства воды |