
Читайте также:
|
УГЛЕРОД
Углерод (лат. Carboneum), С –– химический элемент IV группы периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107 а.е.м. Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб.
Углерод имеет массу аллотропных модификаций, таких как: графит, графен, алмаз, лонсдейлит, уголь, антрацит, сажа
Химические свойства углерода и его соединений.
Одно из главных химических свойств углерода – это сильные восстановительные свойства. Только при сравнительно низких температурах, углерод химически инертен.
Рассмотрим подробнее химические свойства углерода:
- при высоких температурах углерод является окислителем (образовывает карбиды): 4Al+3C=Al4C3
CaO+3C=CaC2+CO
- горение в кислороде С+О2=СО2+Q;
- взаимодействие с оксидом углерода С+СО2=2СО;
- восстановление металлов из оксидов 3С+Fe2O3=3CO2+4Fe.
I. Оксид углерода.
а) Оксид углерода (II)
Оксид углерода – бесцветный газ, без запаха, чрезвычайно ядовитый, в количествах, опасных для жизни, содержится в выхлопных газах, является продуктом сгорания углерода при недостатке кислорода.
В этом соединении углерод проявляет степень окисления +2 и валентность 3
В промышленности получаю путём пропускания углекислого газа над раскалённым углём при высокой температуре
СО2 +С=2СО
При высоких температурах, оксид углерода (II) – сильный восстановитель. Он восстанавливает многие металлы из оксидов. Например:
CO+CuO=Cu+CO2
б) Оксид углерода (IV)
Оксид углерода (IV) – бесцветное газообразное вещество. Он в 1,5 раза тяжелее воздуха, поэтому его можно переливать из одного сосуда в другой.
При температуре обычного пламени при горении углеродосодержащих веществ (дрова, уголь, природный газ метан, спирт и др.) протекает реакция:
С + О2 = СО2
Так же образуется в случаях:
- окисления биохимических процессов, дыхания, гниения,
- сгорания метана:
CH4+O2=CO2+2H2O
- взаимодействия кислот с карбонатами (лабораторный способ):
CaCO3+2HCI=CaCI2+CO2+H2O
- термического разложения карбонатов и гидрокарбонатов:
CaCO3=CaO+CO2
2NaHCO3=Na2CO3+CO2+H2O
Свойства:
1.При растворении взаимодействует с водой, образуя угольную кислоту, тем самым проявляя свойства кислотного оксида. Реакция обратимая:
СО2+Н2О=Н2СО3
2.Реагирует с основными оксидами:
CO2+CaO=CaCO3
3. Реагирует с основаниями:
CO2+Ca(OH) 2=CaCO3+H2O
II. Угольная кислота.
Слабая двухосновная кислота, которая образуется при растворении оксида углерода СО2 в воде: 
Угольная кислота дает два ряда солей:
- водорастворимые гидрокарбонаты (NaHCO3 – питьевая сода, Na2 CO3 – сода, K2 CO3 – поташ),
- нерастворимые (MgCO3, CaCO3).
Реакции образования гидрокарбонатов и карбонатов:
CO2+NaOH=NaHCO3
CO2+2NaOH=Na2CO3+H2O
Соли угольной кислоты подвергаются гидролизу.
Угольная кислота вытесняется из солей более сильными кислотами:
CaCO3+2HCI=CaCI2+CO2+H2O
III. Сероуглерод CS2
В промышленности получают по реакции метана с парами серы в присутсвии силикагеля при температуре 500-700°C в камере из хромоникелевой стали:

При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:

IV. Фосген
Химическое вещество с формулой CCl2O, при нормальных условиях — бесцветный газ с запахом прелого сена. В Первую Мировую Войну использовался как отравляющее вещество.
В лаборатории может быть легко получен несильным нагреванием смеси CCl4и SO3 (или олеума):

Энергично реагирует с аммиаком с образованием карбамида и хлорида аммония:

V. Метан
Метан – простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, формула CH4.
Основной компонент природных (77—99%), попутных нефтяных (31—90%), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, рубце жвачных животных) образуется биогенно. Образуется при взаимодействии углерод с водородом в присутствии никелевого катализатора и при высоких температурах:
C+2H2=CH4
В лаборатории получают нагреванием безводного гидроксида натрия с ледяной уксусной кислотой.

Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен (способность вещества поглощать водяной пар из воздуха).
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия:
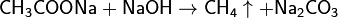
Вступает с галогенами в реакции замещения, которые проходят по свободно радикальному механизму:
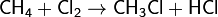



Выше 1400°C разлагается по реакции:

Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
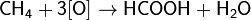
VI. Синильная кислота HCN
В настоящий момент есть три наиболее распространенных метода получения синильной кислоты в промышленных масштабах:
· Метод Андрусова: прямой синтез из аммиака и метана в присутствии воздуха и платинового катализатора при высокой температуре:

· Прямой синтез из аммиака и метана в присутствии платинового катализатора при высокой температуре:
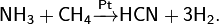
Пары синильной кислоты горят на воздухе фиолетовым пламенем с образованием Н2О, СО2 и N2. В смеси кислорода с фтором горит с выделением большого количества тепла:
 кДж.
кДж.
С хлором, бромом и иодом прямо образует циангалогениды:

С алкенами и алкинами реагирует, присоединяясь к кратным связям:
 - акрилонитрил (применяется при создании синтетических волокон)
- акрилонитрил (применяется при создании синтетических волокон)


Дата добавления: 2015-08-17; просмотров: 130 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Свадебные традиции в Российской империи | | | Создаём зимнюю фотоманипуляцию в Фотошоп |