
|
Читайте также: |
Коагулирующее действие смеси электролитов проявляется по разному, в зависимости от природы ионов, вызывающих коагуляцию. Если электролиты в смеси близки по своим свойствам (например, NaCl и KCl), то коагулирующее действие их суммируется (рис. 70). В этом случае говорят об аддитивности ионов. В некоторых случаях коагулирующее действие многозарядных ионов электролита ослабляется при введении в раствор второго электролита, коагулирующие ионы которого имеют меньшую величину заряда. То есть в этом случае образовавшаяся смесь оказывает более слабое воздействие на золь чем исходный электролит (рис. __). Это явление, получившее название «антагонизм ионов», не всегда находит объяснение.
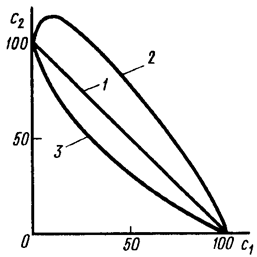
Рис. 70. Коагуляция смесями электролитов: 1 – аддитивность коагулирующего действия; 2 – антагонизм; 3 – синергизм коагулирующего действия
Одной из причин уменьшения коагулирующего действия смеси может быть химическое взаимодействие между ионами электролитов, в результате которого образуются комплексы, не обладающие коагулирующим действием.
Наконец, коагулирующее действие смеси электролитов может возрастать в большей степени, чем по правилу аддитивности (рис. 70).
Это явление называется «синергизмом ионов». Причина его во многих случаях также заключается в химическом взаимодействии между ионами, приводящем к получению многозарядных комплексных ионов, обладающих повышенной адсорбционной способностью. Например:
6KCN + FeCl2 = K4[Fe(CN)6] + 2KCl
6CN– + Fe2+ = [Fe(CN)6]4–
Заряд образовавшегося комплексного аниона в четыре раза больше заряда анионов исходных электролитов смеси.
Дата добавления: 2015-08-02; просмотров: 101 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Чередование зон коагуляции | | | Скорость коагуляции |