
Читайте также:
|
Более того, большое количество циркулирующих биологически активных веществ, таких как брадикинин, серотонин, ацетилхолин, AДФ, тромбин, адреналинн и т. д., также активирует эндотелий, взаимодействуя со специфическими рецепторами, расположенными на стенке эндотелиальных клеток.

|
Наличие чувствительности эндотелиоцитов к скорости кровотока, выражающееся в выделении ими расслабляющего гладкие мышцы сосудов фактора, приводящего к увеличению просвета артерий, обнаружено у всех изученных магистральных артерий млекопитающих, включая человека. Выделяемый эндотелием фактор расслабления в ответ на механический стимул – высоколабильное вещество, принципиально не отличающееся по своим свойствам от медиатора эндотелий-зависимых дилататорных реакций, вызываемых фармакологическими веществами. Последнее положение утверждает «химическую» природу передачи сигнала от эндотелиальных клеток к гладкомышечным образованиям сосудов при дилататорной реакции артерий в ответ на увеличение кровотока. Таким образом, артерии непрерывно регулируют свой просвет соответственно скорости течения по ним крови, что обеспечивает стабилизацию давления в артериях в физиологическом диапазоне изменений величин кровотока. Этот феномен имеет большое значение в условиях развития рабочей гиперемии органов и тканей, когда происходит значительное увеличение кровотока; при повышении вязкости крови, вызывающей рост сопротивления кровотоку в сосудистой сети. В указанных ситуациях механизм эндотелиальной вазодилатации может компенсировать чрезмерное возрастание сопротивления кровотоку, ведущее к уменьшению кровоснабжения тканей, увеличению нагрузки на сердце и уменьшению минутного объема кровообращения. Высказывается мнение, что повреждение механочувствительности сосудистых эндотелиоцитов может быть одним из этиологических (патогенетических) факторов развития облитерирующего эндоартериита и гипертонической болезни.
 Вазодилататор, секретируемый эндотелием: оксид азота (NO)
Вазодилататор, секретируемый эндотелием: оксид азота (NO)
Оксид азота (NO, вначале был обозначен как эндотелиальный фактор релаксации или ЭФР) является наиболее важным вазодилататором, продуцируемым эндотелием сосудов.
Это летучий газ с периодом полураспада всего в несколько секунд, секретируемый эндотелием, быстро распространяющийся в направлении к гладкомышечным клеткам и в сторону просвета сосуда.
| Секреция NO NO образуется в эндотелиальных клетках в процессе трансформации L-аргинина в цитрулин под воздействием NO-синтетазы. Большое количество БАВ (такие как брадикинин, АЦХ, Субстанция P), а также механические раздражители (преимущественно «напряжение сдвига») активируют фермент NO-синтетазу. | 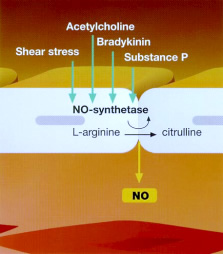
|
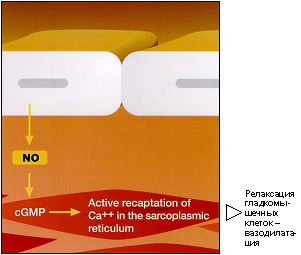
| Роль NO Прямой вазодилатирующий эффект Быстрое распространение NO из эндотелия в нижележащие гладкомышечные клетки вызывает их расслабление за счет повышения уровня циклического гуанинмонофосфата (цГМФ) и соответственно уменьшения концентрации ионов Са внутри клетки. Релаксация сосудистой стенки приводит к уменьшению сосудистого сопротивления и обеспечивает локальную регуляцию артериального давления. Медиатор вазодилатации В дополнение к его эндотелий-зависимому механизму, NO может влиять на сосудистый тонус опосредовано через NANC нейроны, для которых он является одним из основных медиаторов. Хотя, теоретически это может быть важным, точное физиологическое значение данных вазодилатирующих нервов еще не уточнено. Торможение агрегации тромбоцитов Оксид азота также распространяется в просвете сосуда, где тормозит агрегацию тромбоцитов, содействуя таким образом антитромботическим свойствам сосудистой стенки. Другие сосудистые эффекта NO NO тормозит пролиферацию гладкомышечных клеток, адгезию моноцитов, экспрессию молекул адгезии и синтез эндотелина-1 (вазоконстриктора, выделяемого эндотелием, влияющего на гладкомышечные клетки). |
Мелкие артерии, по току крови непосредственно предшествующие капиллярам. Характерная их особенность — преобладание в сосудистой стенке гладкомышечного слоя, благодаря которому артериолы могут активно менять величину своего просвета и, таким образом, сопротивление. Участвуют в регуляцииФизиологическая роль артериол в регуляции кровотока
В масштабе организма, от тонуса артериол зависит общее периферическое сопротивление, которое, наряду с ударным объёмом сердца определяет величину артериального давления. Вследствие этого, артериолы по функциональной классификации относят к резистивным сосудам [1]
Кроме того, тонус артериол может изменяться локально, в пределах данного органа или ткани. Локальное изменение тонуса артериол, не оказывая заметного влияния на общее периферическое сопротивление, будет определять величину кровотока в данном органе. Так, тонус артериол заметно снижается в работающих мышцах, что приводит к увеличению их кровоснабжения.[2]
[править]Регуляция тонуса артериол
Поскольку изменение тонуса артериол в масштабе целостного организма и в масштабе отдельных тканей имеет совершенно различное физиологическое значение, существуют как локальные, так и центральные механизмы его регуляции.
[править] Локальная регуляция сосудистого тонуса
В отсутствие всяких регуляторных воздействий изолированная артериола, лишенная эндотелия, сохраняет некоторый тонус, зависящий от самих гладких мышц. Он называется базальным тонусом сосуда.[3] На сосудистый тонус постоянно влияют такие факторы среды, как pH и концентрация CO2 (снижение первой и повышение второй приводят к уменьшению тонуса). Эта реакция оказывается физиологически целесообразной, так как следующее за локальным снижением тонуса артериол увеличение местного кровотока, собственно, и приведет к восстановлению тканевого гомеостаза.
Далее, эндотелий сосудов постоянно синтезирует как сосудосуживающие (прессорные) (эндотелин[4]), так и сосудорасширяющие (депрессорные) факторы (оксид азота NO ипростациклин[5]).
При повреждении сосуда тромбоциты выделяют мощный сосудосуживающий фактор тромбоксан A2, что приводит к спазму поврежденного сосуда и временной остановке кровотечения[6].
Напротив, медиаторы воспаления, такие, как простагландин E2 и гистамин вызывают снижение тонуса артериол.[5] Изменение метаболического состояния ткани может менять баланс прессорных и депрессорных факторов. Так, снижение pH и увеличение концентрации CO2 смещает баланс в пользу депрессорных влияний.
[править] Системные гормоны, регулирующие сосудистый тонус
Гормон нейрогипофиза вазопрессин, как явствует из его названия (лат. vas — сосуд, pressio — давление) оказывает некоторое, хотя и скромное, сосудосуживающее действие. Гораздо более мощным прессорным гормоном является ангиотензин (греч. ангио — сосуд, тензио — давление) — полипептид, который формируется в плазме крови при снижении давления в артериях почек. Весьма интересным действием на сосуды обладает гормон мозгового вещества надпочечников адреналин, который продуцируется при стрессе и метаболически обеспечивает реакцию «борьбы или бегства». В гладких мышцах артериол большинства органов имеются α-адренорецепторы, вызывающие сужение сосудов, однако в артериолах скелетных мышц и головного мозга преобладают β2-адренорецепторы, которые вызывают снижение сосудистого тонуса. В результате, во-первых, возрастает общее сосудистое сопротивление и, следовательно, артериальное давление, а во-вторых, сопротивление сосудов скелетных мышц и мозга снижается, что приводит к перераспределению кровотока в эти органы и резкое увеличение их кровоснабжения.
[править] Сосудосуживающие и сосудорасширяющие нервы
Все, или почти все, артериолы организма получают симпатическую иннервацию. Симпатические нервы в качестве нейромедиатора имеют катехоламины (в большинстве случаев норадреналин) и имеют сосудосуживающее действие. Поскольку аффинность β-адренорецепторов к норадреналину мала, то даже в скелетных мышцах при действии симпатических нервов преобладает прессорный эффект.
Парасимпатические сосудорасширяющие нервы, нейромедиаторами которых являются ацетилхолин и оксид азота, встречаются в организме человека в двух местах: слюнных железах и пещеристых телах. В слюнных железах их действие приводит к увеличению кровотока и усилению фильтрации жидкости из сосудов в интерстиций и далее к обильной секреции слюны, в пещеристых телах снижение тонуса артериол под действием сосудорасширяющих нервов обеспечивает эрекцию.
[править]Участие артериол в патофизиологических процессах
[править] Воспаление и аллергические реакции
Важнейшая функция воспалительной реакции — локализация и лизис чужеродного агента, вызвавшего воспаление. Функции лизиса выполняют клетки, доставляющиеся в очаг воспаления током крови (главным образом, нейтрофилы и лимфоциты. Соответственно, оказывается целесообразным увеличить в очаге воспаления локальный кровоток. Поэтому «медиаторами воспаления» служат вещества, имеющие мощный сосудорасширяющий эффект — гистамин и простагландин E2. Три из пяти классических симптомов воспаления (покраснение, отёк, жар) вызваны именно расширением сосудов. Увеличение притока крови — следовательно, краснота; рост давления в капиллярах и увеличение фильтрации из них жидкости — следовательно, отёк (впрочем, в его формировании участвует и рост проницаемости стенок капилляров), увеличение притока нагретой крови от ядра тела — следовательно, жар (хотя здесь, возможно, не меньшую роль играет увеличение скорости обмена веществ в очаге воспаления).
Однако, гистамин, кроме защитной воспалительной реакции, является главным медиатором аллергий.
Это вещество секретируется тучными клетками, когда сорбированные на их мембранах антитела связываются с антигенами из группы иммуноглобулинов E.
Аллергия на какое-то вещество возникает, когда против него нарабатывается достаточно много таких антител и они массово сорбируются на тучные клетки в масштабах организма. Тогда, при контакте вещества (аллергена) с этими клетками, они секретируют гистамин, что вызывает по месту секреции расширение артериол, с последующими болью, покраснением и отеком. Таким образом, все варианты аллергии, от насморка и крапивницы, до отёка Квинке и анафилактического шока, в значительной мере оказываются связаны с гистамин-зависимым падением тонуса артериол. Разница состоит в том, где и насколько массивно происходит это расширение.
Особенно интересным (и опасным) вариантом аллергии является анафилактический шок. Он возникает, когда аллерген, обычно после внутривенной или внутримышечной инъекции, распространяется по всему телу и вызывает секрецию гистамина и расширение сосудов в масштабах организма. В этом случае максимально наполняются кровью все капилляры, но их общая ёмкость превышает объём циркулирующей крови. В результате, кровь не возвращается из капилляров в вены и предсердия, эффективная работа сердца оказывается невозможной и давление падает до нуля. Реакция эта развивается в течение нескольких минут и ведёт к гибели больного. Наиболее эффективное мероприятие при анафилактическом шоке — внутривенное введение вещества, обладающего мощным сосудосуживающим действием — лучше всего норадреналина.
общего периферического сосудистого сопротивления (ОПСС).
Трансдукция механических стимулов
Очевидно, что должны существовать чувствительные к растяжению ионные каналы, расположенные на механочувствительных нервных окончаниях, где генерируется рецепторный потенциал. Более того, эти каналы трансдукции должны отличаться от каналов, обеспечивающих генерацию потенциала действия, поскольку ответы на растяжение сохраняются в присутствии местного анестетика, который блокирует распространение возбуждения. Механочувствительные ионные каналы обнаружены в самых разнообразных клетках и органах, включая эндотелиальные клетки кровеносных сосудов, барорецепторы в каротидном синусе, рецепторы прикосновения и давления в коже, мышечные рецепторы растяжения и Механочувствительные волосковые клетки внутреннего уха.
Методом фиксации напряжения было показано, что токи, лежащие в основе рецепторного потенциала в рецепторах растяжения рака, обусловлены увеличением проницаемости как для натрия и калия, так и для двухвалентных катионов, а также для более крупных органических катионов, таких как трис (три аминометан) и аргинин. Увеличение проводимости, вызванное растяжением, не чувствительно к тетродотоксину, однако подвержено влиянию некоторых местных анестетиков. Рецепторные потенциалы в мышечных веретенах позвоночных также связаны с увеличением катионной проницаемости.
Одиночные каналы, активируемые прогибанием мембраны (membrane distortion), впервые наблюдали в мембранных кусочках (пэтчах) из эмбриональных мышечных клеток цыпленка и в мембранах других клеток, не имеющих отношения к сенсорной трансдукции. Пэтч-отведения активности похожих каналов, сделанные на первичных дендритах рецептора растяжения рака, показывают, что относительные проницаемости этих каналов для натрия, калия и кальция согласуются с более ранними наблюдениями, сделанными на целой клетке. О том, как деформация мембраны вызывает открывание каналов, пока почти ничего не известно.Механочувствительные волосковые клетки уха позвоночных
Наше понимание механотрансдукции продвинулось дальше всего в изучении волосковых клеток позвоночных. Механочувствительные волосковые клетки внутреннего уха реагируют на акустическую вибрацию или движения головы, вызывающие перемещение жидкости в полостях внутреннего уха. Точная форма перемещения жидкости зависит от конфигурации и состава конкретного концевого органа, задействованного в каждом процессе. В главе 18 мы обсуждаем частотно-специфичный паттерн колебаний мембран в спирали улитки и различные функции внутренних и внешних волосковых клеток для слухового восприятия. Здесь достаточно будет указать, что волосковые клетки в улитке (cochlea) стимулируются движениями жидкости в диапазоне акустической частоты - у человека от 20 до 20000 Гц. Вестибулярные концевые органы внутреннего уха построены совершенно иначе и реагируют на гораздо более низкие частоты, возникающие при движениях головы. Гравитационная нагрузка на мешочек (saccule) и маточку (utricle), создаваемая содержащей кристаллики отолитовой мембраной (otolithic membrane), обеспечивает чувствительность этих эпителиальных структур к линейному ускорению. Волосковые клетки в полукружных каналах (semicircular canals) активируются угловым ускорением при вращении головы. Независимо от типа движения, перемещение жидкости вызывает отклонение пучка модифицированных микроворсинок, или стереоцилий, которые отходят от апикальной поверхности волосковой клетки. Отклонение пучка напрямую приводит к открыванию механочувствительных ионных каналов.
Структура рецепторов волосковых клеток
Волосковые клетки и окружающие их вспомогательные клетки формируют эпителиальные слои, которыми отделены друг от друга разнородные жидкие среды внутреннего уха. Базально-латеральные участки мембраны волосковых клеток омываются перилимфой, сходной по составу с обычной внеклеточной жидкостью, содержащей много натрия и мало калия. Апикальная поверхность волосковой клетки, формирующая волоски, повернута в сторону эндолимфы, раствора, сходного определенным образом с цитоплазмой и содержащего калий в высокой концентрации, а натрий и кальций - в низкой. Волосковые клетки на своих базально-латеральных поверхностях формируют синоптические контакты с афферентными волокнами. Некоторые волосковые клетки также получают синоптические входы от эфферентных нейронов ствола мозга.
На волосковых клетках разных типов, независимо от места их расположения, находится от нескольких десятков до сотен ранжированных по высоте стереоцилий (видоизмененных микроворсинок, содержащих филаменты полимеризованного актина). Самые длинные стереоцилий обнаружены на волосковых клетках полукружных каналов, самые короткие - в высокочастотной области улитки. В составе любого пучка стереоцилий расположены в порядке повышения высоты, как трубы органа или как ступеньки лестничного марша. Во многих волосковых клетках находится только один настоящий волосок, киноцилий (содержащий набор из 9 + 2 микротрубочек), который находится возле центра самого высокого ряда стереоцилий. В волосковых клетках улитки киноцилии присутствуют только в раннем онтогенезе, позже они исчезают. Стереоцилий закреплены своим основанием в покровной пластинке. Во время отклонения пучка стереоцилий ведут себя как жесткие удилища и сгибаются только в месте прикрепления). Разнообразные боковые сочленения способствуют тому, что скопление стереоцилий перемещается как единый колосковый пучок.
Трансдукция через отклонение волоскового пучка
Уже несколько лет известно, что электрические реакции в волосковых клетках возникают благодаря деформации волоскового пучка, однако для непосредственного экспериментального подтверждения этого потребовалась разработка чувствительной аппаратуры, которая могла бы вызвать и измерить ничтожно малые перемещения при отведении от волосковых клеток. Слуховой и вестибулярный эпителий холоднокровных позвоночных, таких как черепахи и лягушки, оказался наиболее удобным для проведения таких опытов. Процедуры, использованные Кроуфордом и Феттиплейсом для стимуляции волосковых клеток в базальном сосочке (basilar papilla) черепахи (слуховой эпителий, аналог органа Корти у млекопитающих). Базальные сосочки были извлечены из внутреннего уха и помещены в солевом растворе в камеру, смонтированную на предметном столике микроскопа. Микроэлектрод записывает потенциал мембраны волосковой клетки, в то время как стекловолокно, прикрепленное к пьезоэлектрическому манипулятору, давит на пучок волосков. Проецируя изображение стекловолокна на пару фотодиодов, можно уловить смещения всего на 1 нм. Такой стимул производит в волосковой клетке изменение потенциала величиной в 0,2 мВ.
Хадспет и его коллеги детально описали процесс трансдукции в вестибулярных волосковых клетках лягушки. В одной из серий экспериментов они непосредственно продемонстрировали функциональную ориентацию волоскового пучка, варьируя направление стимуляции, осуществляемой пьезоэлектрическим манипулятором. Отклонения в сторону киноцилия деполяризовали клетку, тогда как движение от него приводили к гиперполяризации. Отклонение пучка в направлении, перпендикулярном этой оси, не вызвало изменений мембранного тока. Величина изменения потенциала, генерируемого в волосковой клетке, изменяется в зависимости от угла отклонения пучка.
Концевые связи и воротные пружины
Какая структурная особенность волоскового пучка могла бы лежать в основе ориентационной избирательности трансдукции? Пикльз и коллеги, используя сканирующий электронный микроскоп, описали уникальный класс внеклеточных связей, соединяющих верхушки одного волоска с боковой поверхностью соседнего, более длинного волоска. Эти концевые связи наблюдались только вдоль оси механической стимуляции (т. е. ориентированы вверх и вниз по «лестнице»). Положение концевых связей позволяет предположить, что они могут быть вовлечены в механотрансдукцию, а воздействие, разрывающее концевую связь, должно прекращать трансдукцию. Действительно, внеклеточные отведения указывают на то, что каналы, активируемые механическим стимулом, расположены вблизи вершины волоскового пучка.
Количественные измерения трансдукции и идентификация концевых связей были объединены в гипотезе воротной пружины (gating spring), описывающей механизм механотрансдукции в волосковых клетках. Отклонение волоскового пучка в «позитивном» направлении (в сторону более высоких волосков) увеличивает расстояние между концами волосков, растягивает воротную пружину, открывая таким образом ворота каналов трансдукции. Когда пучок смещается в сторону, противоположную более длинным волоскам, происходит сжатие пружины, и каналы закрываются. Хотя такая схема может показаться достаточно идеализированной, однако требование прямой физической связи между механикой пучка и открыванием канала диктуется огромной скоростью, с которой в волосковых клетках происходит трансдукция, имеющая постоянную времени открывания около 40 мкс. К тому же энергетика и механика трансдукции согласуются с данной моделью. Например, можно измерить уменьшение жесткости пучка по мере того, как открываются каналы трансдукции, так, будто это молекулярное движение действительно снимает напряжение с воротной пружины.Каналы трансдукции в волосковых клетках
Какого типа каналы открываются на концах волосковых клеток? Оказалось, что это неизбирательные катионные каналы, имеющие значительную кальциевую проводимость. Проводимость одиночного канала - около 100 пСм. На основании этих данных, а также измерений величины общего генераторного тока можно рассчитать, что каждая волосковая клетка имеет около 100 каналов трансдукции. Это соответствует всего нескольким каналам на один стереоцилий.
Очень малое количество каналов в каждой волосковой клетке существенно затрудняет их биохимическое и молекулярно-биологическое исследование. Каналы трансдукции волосковых клеток не являются потенциалзависимыми и не открываются какими-либо лигандами в традиционном смысле этого слова. Поэтому маловероятно, что возможна жесткая гомологичность между ними и другими классами управляемых ионных каналов, для которых гены уже описаны. Однако все больше механочувствительных ионных каналов клонируется из бактерий, дрожжей, нематод и мух, так что гены-претенденты, скорее всего, будут определены в ближайшем будущем.
Адаптация волосковых клеток
Волосковые клетки чрезвычайно чувствительны, пороговые ответы в них возникают при смещении волоскового пучка менее чем на 10--9 м. Поэтому кажется весьма вероятным, что некоторые виды адаптивных процессов должны восстанавливать чувствительность в присутствии «фоновых» стимулов. Например, вестибулярные волосковые клетки в маточке и мешочке должны оставаться чувствительными к самым незначительным движениям головы, испытывая постоянное влияние силы тяжести, действующей на покровную отолитовую мембрану. Путем прямого измерения можно показать, что в процессе длительного смещения волосковые клетки действительно адаптируются.
Результат эксперимента, в котором постоянное отклонение на 0,65 мкм было приложено к пучку ресничек волосковой клетки черепахи, мембранный потенциал в которой устанавливался на разных уровнях путем фиксации напряжения. При -72 м В входящий трансдукционныи ток сначала достигал на пике 100 пА, а затем спадал с постоянной времени примерно 10 мс. Это адаптивное изменение вызвано притоком ионов кальция через открытые трансдукционные каналы. Когда потенциал мембраны был фиксирован на +60 мВ, то возникал выходящий трансдукционный ток (равновесный потенциал равен 0 мВ), который сохранялся неизменным, адаптация при этом устранялась. При +60 мВ движущая сила для кальция мала, и в клетку проникает небольшое количество кальция. В других экспериментах адаптация также устранялась удалением кальция из внеклеточного раствора или внутриклеточной инъекцией сильных кальциевых хелаторов).
В некоторых волосковых клетках адаптация сопровождается изменениями жесткости пучка, что предполагает «переустановку» жесткости воротной пружины). Это наблюдение, в сочетании с кальциевой зависимостью адаптации, привело к предположению, что движение миозина вдоль актинового каркаса стереоцилии может смещать положение места прикрепления концевой связи, изменяя жесткость пучка. Путем клонирования миозинов из внутреннего уха и использования специфических антител, было показано, что миозин? (немышечная форма) расположен вблизи концов стереоцилии в волосковых клетках лягушки. Эта относительно медленная адаптация, основанная на действии миозина, вероятно, является наиболее значимой в вестибулярных волосковых клетках. Более быстрая форма адаптации в слуховых волосковых клетках обусловлена ионами кальция, действующими непосредственно на трансдукционные каналы, заставляя их закрываться.
Тесная связь между механическим входом и открыванием трансдукционного канала имеет важные последствия для функции внутреннего уха. Такая тесная связь предполагает, что в процессе трансдукции будет возникать отрицательная обратная связь. Таким образом, рецепторный потенциал изменяет вход кальция (через изменение движущей силы), приводя к изменениям жесткости или положения волоскового пучка. Действительно, изменение мембранного потенциала волосковых клеток черепахи приводит волосковый пучок в движение.
Дата добавления: 2015-08-02; просмотров: 84 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Механические стимулы | | | Разделение персонала по функциям |