
Читайте также:
|
Химические свойства.
Строение электронной оболочки.
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5, поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие степени окисления. Схема образования возбуждённых состояний атома:
| Валентность | Возможные степени окисления | Электронное состояние валентного уровня | Пример соединений |
| I | +1, −1 | 3s2 3p5 | NaCl, NaClO |
| III | +3 | 3s2 3p4 3d1 | NaClO2 |
| V | +5 | 3s2 3p3 3d2 | KClO3 |
| VII | +7 | 3s1 3p3 3d3 | KClO4 |
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):

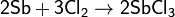

Дата добавления: 2015-08-10; просмотров: 54 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства йодида калия | | | Методы индикации ОХВ и ОВ. |