
Читайте также:
|
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи. силы притяжения между неполярными частицами (атомами, молекулами) являются весьма короткодействующими. Значения энергии такого притяжения зависят размеров частиц и числа электронов в наведенных диполях. Эти связи очень слабые - самые слабые из всех межмолекулярных взаимодействий. Однако они являются наиболее универсальными, так как возникают между любыми молекулами.
Таким образом, дисперсионное взаимодействие наблюдается между всеми молекулами, в том числе между молекулами, дипольный момент которых равен нулю. Обусловлено это флуктуацией электронной плотности в молекуле и образованием коротко живущих диполей (время жизни – 10-8 сек). Взаимодействие между этими диполями определяет величину дисперсионного взаимодействия. Способность к смещению электронной плотности (поляризуемость) увеличивается у атомов и молекул, в которых эти атомы включены, тем выше, чем больше радиус атомов. Таким образом, дисперсионное взаимодействие соединений одной подгруппы возрастает сверху вниз. Например, в ряду неполярных молекул F2, Cl2, Br2, I2 наблюдается рост температур кипения и плавления.
Существуют, однако, такие молекулы у которых нет не только дипольного электрического момента, но и электрических моментов более высокого порядка; это - сферически симметричные молекулы, прежде всего молекулы идеальных газов. Однако и благородные газы при охлаждении сжижаются, а при дальнейшем охлаждении образуют (гелий - только под повышенным по сравнению с атмосферным давлением) атомные и кристаллы. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы (например, метан).
Энергия дисперсионного взаимодействия, так же как ориентационного и индукционного взаимодействий, пары частиц обратно пропорциональна шестой степени расстояния между ними.
Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться, причем, энергия отталкивания обратно пропорциональна двенадцатой степени расстояния между ними. На малых расстояниях силы отталкивания значительно больше сил притяжения:
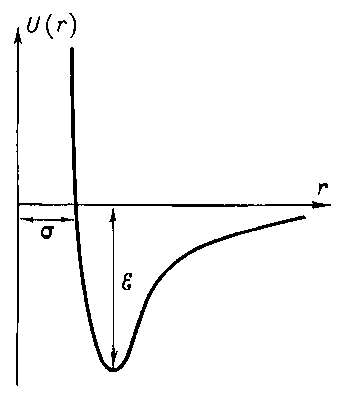
Рис. График зависимости величины потенциальной энергии межмолекулярного взаимодействия от расстояния между молекулами
Контрольные вопросы
1.Что такое химичеcкая связь? Укажите условия ее образования.
2. Назовите основные типы химической связи и их основные характеристики.
Дайте определение ковалентной связи. Какова схема ее образования (на примере молекул Н2, Cl2, HCl)?
3. Каковы основные положения метода валентных связей? Что такое гибридизация атомных орбиталей и как она связана со строением молекул? Что такое резонансные структуры?
4. Назовите основные положения метода молекулярных орбиталей. Дайте определение понятиям связывающие, несвязывающие и разрыхляющие молекулярные орбитали, d- и p-связи.
5. Какова структура энергетических уровней МО двухатомных молекул элементов второго периода? Объясните причину устойчивости молекулярного иона H2+, а также увеличение прочности связи в молекулярных ионах O2+, F2+ по сравнению с прочностью связи в нейтральных молекулах O2 и F2.
6. Какие двухатомные молекулы элементов второго периода проявляют диамагнитные, а какие парамагнитные свойства?
7. Что такое водородная связь и как она образуется?
8. Какие типы межмолекулярного взаимодействия вы знаете? Как межмолекулярное взаимодействие зависит от дипольного момента молекул?
Дата добавления: 2015-08-10; просмотров: 110 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ориентационное взаимодействие | | | Решение типовых задач |