
|
Читайте также: |


Химическое равновесие
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно,

В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным, или динамическим, равновесием. И поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ — как исходных, так и образующихся — остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [H2], [N2], [NH3], тогда как неравновесные концентрации обозначают так:
СH2, CN2> CNH3.
На состояние химического равновесия оказывают влияние концентрации реагирующих веществ, температура, а для газообразных веществ — и давление. При изменении одного из параметров равновесие нарушается и концентрация всех реагирующих веществ изменяется до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния
равновесия к другому называется смещением (или сдвигом) химического равновесия. Если при изменении условий увеличивается концентрация конечных веществ, то говорят о смещении равновесия в сторону продуктов реакции. Если же увеличивается концентрация исходных веществ, то равновесие смещается в сторону их образования.
Химическое равновесие называется динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменения в системе незаметны.
Количественной характеристикой равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
Н2 + I2 «2НI
Согласно закону действия масс, скорости прямой (v1) и обратной (v2) реакций выражаются уравнениями (cистема рассматривается при повышенной температуре, когда иод находится в состоянии пара)
v1=k1[H2][I2]
v2=k2[HI]2
При равновесии скорости прямой и обратной реакций равны друг другу, откуда:
k1[H2][I2]=k2[HI]2 или
k1/k2=[HI]2/[H2][I2]
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции К:
k1/k2=К или, отсюда окончательно, [HI]2/[H2][I2]=К. В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии, — равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
Можно показать, что в общем случае обратимой реакции:
аА+bB+... «рР + qQ+... константа равновесия выразится уравнением:
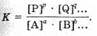
Здесь большие буквы обозначают формулы веществ, а маленькие — коэффициенты в уравнении.
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменение концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. Например, при K>>1 выход реакции велик, потому что при этом
[Р]p[Q]q>>[А]a[B]b...
т.е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При К<<1 (по аналогичной причине) выход реакции мал.
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит. Как уже было сказано, константа равновесия Равна отношению констант скорости прямой и обратной реакций. Поскольку катализатор изменяет энергию активации и прямой, в обратной реакций на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия.
Дата добавления: 2015-08-10; просмотров: 286 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| БИЛЕТ № 25 | | | Смещение равновесия. Принцип Ле Шателье |