
Читайте также:
|
При заболеваниях паренхимы в крови резко увеличен уровень органо-специфического фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность холинэстеразы.
При незначительных поражениях гепатоцитов: в плазме крови увеличивается активность цитоплазматических ферментов печени (АлАТ, АсАТ, сорбитолдегидрогеназы, g-глутамилтранспептидазы).
При сильном поражении гепатоцитов повышается активность митохондриальных ферментов: глутамилдегидрогеназы, митохондриальной АсАТ.
При механической желтухе в крови возрастает щелочная фосфатаза и лейцинаминопептидаза.
При длительном декомпенсированном поражении снижается активность холинэстеразы, ЛХАТ, содержание факторов свертывания крови и общее содержание белков крови.
56. Метаболизм этанола осуществляется тремя ферментативными системами: 1) алкогольдегидрогеназной (80%) 2) микросомальной этанолокисляющей системой (МЭОС – 15%) 3) каталазой (5%).
1) Алкогольдегидрогеназа наиболее активно метаболизирует этанол в печени, преимущественна локализована в цитозоле клеток (только 10% - в ЭПС и митохондриях). Катализирует реакцию образования ацетальдегида: этанол + НАД+ ® ацетальдегид + НАДН+Н+.
2) МЭОС катализирует реакцию: этанол + НАДФН+Н+ + О2 ® ацетальдегид + 2 Н2О.
3) каталаза катализирует реакцию: этанол + Н2О2 ® ацетальдегид + 2 Н2О.
Образующийся ацетальдегид далее окисляется ацетальдегиддегидрогеназой в уксусную кислоту, которая превращается в ацетил-КоА и 1) вступает в ЦТК или 2) идет на синтез ВЖК и холестерола. В сутки в тканях человека образуется и окисляется 1-9 г этанола.
Механизм развития жировой инфильтрации и дегенерации печени: избыточное потребление этанола ® увеличение содержания в гепатоцитах ВЖК и холестерола ® в печени происходит интенсивные распад и синтез фосфолипидов из компонентов нейтрального жира, однако для данного процесса необходимы неорганические фосфаты и так называемые липотропные факторы (холин) ® липотропные факторы не поступают или поступают в малом количестве ® накопление нейтральных жиров в гепатоцитах ® жировая инфильтрация печени и ее дегенерация.
57. Компоненты системы микросомального окисления (монооксигеназного пути окисления):
1) неполярный окисляемый субстрат
2) кислород
3) дополнительный субстрат (косубстрат) – донор водорода НАДФН+Н+.
4) флавопротеин
5) цитохром P450 – связывает субстрат окисления и активирует молекулярный кислород.
58. Бикарбонатная буферная система крови – наиболее важный буфер организма (10% буферной емкости крови). Поддерживаемая рН ~ 7,40. Компоненты: Н2СО3/NaHCO3.
Механизм действия:
1) Н+ + HCО3- ® Н2СО3 (слабо диссоциирующая). Последующее снижение концентрации угольной кислоты достигается в результате гипервентиляции легких и ускоренном выведении СО2.
2) OH- + H2CO3 ® H2O + HCО3-. При этом реализуется гиповентиляция легких для сохранения в плазме СО2и ускоренном выведении СО2.необходимы неорганические фосфаты и хондриальной АсАТ
Гемоглобиновая и оксигемоглобиновая буферные системы крови – самые мощные в организме (более 75 всей буферной емкости крови), функционирует только в сочетании с гидрокарбонатной. Компоненты: KHb/HHb (гемоглобиновая буферная система), KHbO2/HHbO2 (оксигемоглобиновая буферная система).
Механизм действия:
HbO2- + Н+ «ННbO2® ННb + O2
HHbO2 + OH- «HbO2- + H2O
HHb + OH- «Hb- + H2O
Hb- + H+ ® HHb
Бикарбонатная и гемоглобиновая система взаимосвязаны между собой: КНb + Н2СО3 ® KHCO3 + HHb
59. Фосфатная буферная система крови – буферная емкость ~ 1% буферной емкости крови, однако является одной из самых основных в тканях. Компоненты в клетках: KH2PO4/K2HPO4. Поддерживаемая рН ~ 7,2. Механизм: H2PO4- (донор протонов) «H+ + HPO42-(акцептор протонов)
Белковые буферные системы – поддерживают рН в пределах 7,2-7,4. Амфолитные, т.е. имеют и кислотные (карбоксильные), и основные (амино-) группы в молекуле.
Механизм действия белковых буферных систем:
| кислотная буферная система: | основная буферная система |
| +H3N-R-COOH + OH- «+H3N-R-COO- + H2O +H3N-R-COO- + H+ «+H3N-R-COOH | H2N-R-COO- + H+ «+H3N-R-COO- +H3N-R-COO- + OH- «H2N-R-COO- + H2O |
60. Структура гемоглобина: 4 молекулы небелкового компонента – гема (тетрапиррольное кольцо из четырех пиррольных колец, соединенных между собой метиновыми мостиками (-СН=) - система протопорфирина IX + не изменяющее валентность Fe2+) и белковый компонент – глобин (4 белковые субъединицы: 2α- и 2β-субъединицы). Каждая молекула гема обернута полипептидной цепью
Физиологические Hb: а) Нb A1 (2α- и 2β- цепи) – 90-95% б) Hb A2 (2α- и 2s-цепи) – 2,5% в) HbF (2α- и 2g-цепи) – 1,5% у взрослого, 80% у новорожденного.
Аномальные гемоглобины – до 150 типов, возникают в результате мутации генов, кодирующих синтез глобинов, чаще в результате замены АК в α- или β-цепи: HbC, HbDα, HbDβ, HbE, HbG, HbI, HbO, HbS (cерповидноклеточной анемии), HbH (все цепи нормальные, но состоит из четырех β- цепей). Наличие аномальных гемоглобинов обуславливает различные гемоглобинопатии.
Производные гемоглобина: физиологически нормальные а) оксигемоглобин (HbO2 без изменения валентности Fe) б) карбоHb (HbCO2) и патологические в) метHb (возникает при воздействии сильных окислителей на ион Fe2+, который становится трехвалентным Fe3+ и не может переносить кислород) г) карбоксиHb (HbCO – возникает при отравлении человека угарным газом).
61. Г ипоксия – кислородное голодание – состояние, возникающее при недостаточном снабжении тканей организма кислородом или нарушении его утилизации в процессе биологического окисления.
I. Гипоксия вследствие понижения PО2 во вдыхаемом воздухе (экзогенная гипоксия) – возникает а) при подъеме на высоту б) при авариях в шахтах, неполадках на подводных лодках и т.п. Характеризуется развитием гипоксемии – уменьшением PО2 в артериальной крови и снижением насыщения гемоглобина кислородом.
II.Гипоксия при патологических процессах, нарушающих снабжение тканей кислородом при нормальном его содержании в окружающей среде.
а) дыхательный (легочной) тип – из-за альвеолярной гиповентиляции вследствие а) обструкции дыхательных путей (воспаление, отек, спазм) б) уменьшения дыхательной поверхности легких (отек легкого, пневмония). Часто к гипоксии присоединяется гиперкапния.
б) сердечно-сосудистый (циркуляторный) тип – при нарушения кровообращения, приводящего к недостаточному кровоснабжению органов и тканей.
в) кровяной (гемический) тип – в результате уменьшения кислородной емкости крови 1) при анемиях из-за а) уменьшения эритроцитов б) снижения содержания Hb в эритроцитах 2) при отравлениях угарным газом 3) при действии на Hb сильных окислителей (образование метгемоглобина)
г) тканевой (гистотоксический) тип – из-за нарушения способности ткани поглощать кислород из крови из-за 1) угнетения биологического окисления ингибиторами типа цианида, блокирующего цитохромоксидазу 2) нарушения синтеза ферментов 3) повреждения мембранных структур клетки.
62. Механизмы транспорта углекислого газа кровью.
а) часть СО2 переносится в физически растворенном виде (~ 6-7% всего СО2)
б) в карбаминовой форме (СО2, присоединенный к гемоглобину посредством карбаминовой связи) (~ 3-10% всего СО2)
3) в форме бикарбоната (более 80% всего СО2):
1. KHbO2 ® O2 + KHb (в периферических капиллярах большого круга кровообращения, кислород поступает при этом в ткани из эритроцитов).
2. В обмен на кислород из тканей в эритроцит поступает СО2. В эритроците: СО2 + H2O ® H2CO3 (под действием карбоангидразы), КHb + H2CO3 ® K+ + HCO3- + HHb.
3. Гидрокарбонат ионы выходят из эритроцитов в плазму, взамен в эритроцит поступают анионы хлора, для которых проницаема мембрана эритроцита. Для катионов натрия мембрана эритроцита не проницаема, они остаются в плазме и повышают содержание в ней NaHCO3 (восстанавливает щелочной резерв крови).
4. В легочных капиллярах: НHb + О2 ® HHbО2, HHbО2 + K+ + HCO3-® KHbO2 + H2CO3.
5. H2CO3 ® СО2 + H2O (под действием карбоангидразы). Углекислый газ диффундирует при этом в легкие.
6. Т.к. в эритроцитах снижается концентрация гидрокарбонат ионов, в них из плазмы поступают новые порции гидрокарбонат ионов, а в плазму выходят хлорид ионы.
63. Индикаторные ферменты крови и их диагностическое значение:
| Фермент | Орган | Заболевание |
| АлАТ | печень, скелетные мышцы | паренхиматозные заболевания |
| АсАТ | печень, скелетные мышцы, сердце, почки, эритроциты | ИМ, паренхиматозные заболевания печени, мышц |
| Альдолаза | скелетные мышцы, сердце | болезни мышц |
| Кислая фосфатаза | предстательная железа, эритроциты | рак предстательной железы |
| Щелочная фосфатаза | печень, костная ткань, слизистые оболочки, плацента, почки | заболевания костной ткани, печени |
| Амилаза | слюнные железы, поджелудочная железа, яичники (активность повышена на высоте острого панкреатита) | заболевания поджелудочной железы |
| Холинэстераза | печень | отравление фосфорорганическими инсекцидами, болезни печени |
| Креатинкиназа | скелетные мышцы, ГМК, мозг, сердце | ИМ, заболевания мышц |
| ГлутаматДГ | печень (митохондрии) (свидетельствует о глубоком поражении клеток) | паренхиматозные заболевания печени |
| g-глутаматтраспептидаза | печень, почки ( при холестазе) | заболевания печени, алкоголизм |
| лактатДГ | сердце, печень, скелетные мышцы, эритроциты, л.у. | ИМ, гемолиз, паренхиматозные заболевания печени |
64. Гемостаз – все процессы, направленные на сохранение крови в кровеносном русле, препятствующие кровоточивости и обусловливающие восстановление кровотока в случае обтурации сосуда тромбом.
Механизмы гемостаза: а) сосудисто-тромбоцитарный (микроциркуляторный, первичный, клеточный) б) коагуляционный (макроциркуляторный, плазменно-тромбоцитарный, вторичный).
Основные структурно-функциональные компоненты гемостаза: 1) стенка кровеносного сосуда 2) клетки крови (преимущественно тромбоциты, также эритроциты, лейкоциты) 3) система свертывания крови.
65. Функциональные звенья системы свертывания крови и их биологическая роль:
а) свертывающая (гемокоагуляционная) система – препятствует кровоточивости и потере крови путем образования нерастворимого фибрина.
б) противосвертывающая (антитромботическая) система: антикоагулянтная и фибринолитическая – поддерживают жидкое состояние циркулирующей крови, обуславливают восстановление кровотока в случае закупорки сосуда тромбом.
66. Свертывающая система крови – процессы, направленные на образование в сосуде нерастворимого фибрина, препятствующего потере крови в случае его повреждения.
Компоненты ССК:
а) плазменные ферментные факторы гемокоагуляции (факторы I-XIII, высокомолекулярный кининоген, прекалликреин) – преимущественно сериновые протеазы, секретируются в кровь из гепатоцитов в виде прокоагулянтов, осуществляют активацию свертывания крови по механизму частичного протеолиза.
б) плазменные не ферментные факторы гемокоагуляции (ф. Va и VIIIа).
в) коагуляционные тромбоцитарные факторы (Р1-Р11) – образуются тромбоцитами, участвуют в гемокоагуляции.
г) ионы Са2+ - 1) активируют некоторые факторы свертывания крови 2) связывают на тромбопластинах витамин К-зависимые факторы свертывания крови (ф. II, VII, IX, X) 3) стабилизируют структуру тромбопластина.
д) надмолекулярные структуры – сосудистая стенка (стимулятор и регулятор свертывания)
67. Гемокоагуляция – цепной каскадный ферментативный процесс, в ходе которого происходит взаимодействие и последовательная активация ряда сериновых протеаз на фосфолипидных матрицах (тромбопластинах), заканчивающаяся превращением растворимого фибриногена в нерастворимый фибрин.
Биологический смысл каскадного механизма гемокоагуляции: многоэтапный биохимический каскад обуславливает значительное усиление сигнала, инициирующего свертывание крови.
Фазы гемокоагуляции:
1) 1-ая фаза – образование протромбиназы (активного тромбопластина крови): 4 мин 50 с – 6 мин 50 с.
2) 2-ая фаза – образование тромбина: 2-5 с.
3) 3-ая фаза - образование фибрина: 2-5 с.
4) 4-ая фаза, посткоагуляционная, - ретракция, т.е. образование гемостатически полноценного сгустка: 55-85 мин.
68. См. в. 67. Время свертывания крови по Ли-Уайту 5-7 мин.
69. Каскад реакций гемокоагуляции происходит на фосфолипидных микромембранах (фосфолипидных матрицах), источником которых служат:
а) фрагменты плазматических мембран активированных тромбоцитов (P3), эритроцитов (эритропластин) и др. клеток
б) фосфолипидный компонент тканевого тромбопластина (ф. III – содержит белок апо B III)
70. Отличия внешнего и внутреннего механизма гемокоагуляции:
1) внешний механизм – тромбопластин приходит извне из поврежденных тканей, внутренний механизм – все необходимые факторы, в том числе и тромбопластин, находятся в кровеносном русле
2) внутренний механизм – более медленный процесс, чем внешний
3) внутренний механизм включает большее число факторов свертывания, чем внешний.
Общие этапы: начиная со 2-ого (образование тромбина).

71,72. Внешний механизм свертывания крови запускается при 1) появлении в кровотоке обломков клеточных мембран в результате травмы 2) продукции тканевого тромбопластина эндотелиоцитами при стазе крови, гипоксии, ацидозе, действии на эндотелий протеиназ и токсинов.
73, 74, 75,76,77, 78, 79, 80, 81. Внутренний механизм свертывания крови запускается а) контактом крови с измененной или чужеродной поверхностью, по смачиваемости отличной от эндотелия (поврежденная стенка сосудов или измененная вследствие васкулитов, атеросклероза, интоксикации) б) иммунными комплексами, адреналином, жирными кислотами, холестеролом, бактериальными липопротеинами.
82. У людей с наследственной недостаточностью фактора Хагемана кровь не сворачивается в пробирке, т.к. при этом выключается внутренний механизм гемокоагуляции. В организме больного кровь сворачивается по внешнему пути.
83. Роль тромбоцитов в процессе гемокоагуляции:
1) участвуют, как и другие клетки крови, в образовании первичного клеточного тромба
2) участвуют в активации гемокоагуляции (создают поверхность для взаимодействия и активирования факторов свертывания крови)
3) защищают факторы свертывания от разрушения ингибиторами плазмы
4) выделяют факторы, активирующие процесс тромбообразования
84. Концентрация фибриногена в крови: 2,0-4,0 г/л. Схема превращения фибриногена в фибрин:
фибриноген (А2α2В2β2g2) ®фибринопептиды А и В + фибрин-мономер (α2β2g2) (под действием тромбина) ® растворимые фибрин-мономерные комплексы® фибрин S (нестабилизированный фибрин-полимер) ® фибрин I (стабилизированный фибрин-полимер) (под действием фибринстабилизирующего фактора ф. XIII).
Растворимый, или нестабилизированный полимер фибрина (фибрин S) – распадается в кислой среде и в растворе мочевины, легко расщепляется протеиназами. Нерастворимый, или стабилизированный, фибрин (фибрин I) – резистентный к протеазам, более эластичный и прочный.
85. См. в. 66. Содержание ионов кальция в крови: общее количество 2,0-2,5 ммоль/л, ионизированного кальция: 1,0-1,3 ммоль/л.
86. Витамин К – по структуре схож с витамином E, имеет хиноновое кольцо и изопреновый радикал. Разновидности витамина K: вит. К1 (филлохинон) и вит. К2 (менахинон-6). Источники: смешанная пища (особенно зеленые растения) и кишечная микрофлора.
Роль витамина К в гемокоагуляции (работает в составе g-глутамилкарбоксилазы):
а) антигеморрагический фактор – пострансляционное созревание факторов II, VII, IX, X
б) участвует в созревании витамин К-зависимых антикоагулянтов (протеинов C и S)
87. Антикоагулянтная система – ряд ингибиторов свертывания, осуществляющий контроль скорости активирования факторов и реакций между ними. Физиологические антикоагулянты:
а) первичные – постоянно синтезируются в организме и с постоянной скоростью выделяются в кровоток, взаимодействуют только с активными факторами коагуляции, нейтрализуя их (антитромбин III, гепарин, α2-макроглобулин, протеины С и S, ЛАКИ и др).
б) вторичные – образуются из факторов свертывания и других белков в процессе свертывания крови, фибринолиза и активации других протеолитических систем (антитромбин I, метафактор Va, метафактор XIа, продукты фибринолиза, продукты деградации фибриногена)
88, 89. Наиболее значимые естественные антикоагулянты:
а) антитромбин III – необратимо ингибирует большинство сериновых протеаз свертывающей системы (ф. IIa, IXa, Xa, XIa, XIIa), основной плазменный кофактор гепарина, особенно ингибирует тромбин.
б) гепарин – в 1000 раз повышает активность антитромбина III.
в) протеины C и S – разрушают факторы ф.Va, VIIIa и ингибируют образование фактора Xa и тромбина.
г) α2-макроглобулин – препятствует действию тромбина на фибриноген
д) ЛАКИ – ингибирует внешний механизм свертывания, связываясь с факторами VIIa и Xa.
90. Гепарин – активирует антитромбин III, повышая его активность в 1000 раз, а АТ III препятствует сворачиванию крови, ингибируя большинство факторов свертывания. Также гепарин самостоятельно способен ингибировать ряд протеиназ.
91. Дикумарол – антагонист витамина К, он ингибирует восстановление хиноновых производных витамина К в активные гидрохиноновые формы, препятствуя созреванию вит. К-зависимых факторов системы свертывания, что сопровождается выключением плазменных факторов VII, IX, X, II из процесса коагуляции крови. Свертывание крови в пробирке сохраняется при добавлении в нее дикумарола, т.к. дикумарол оказывает эффект не сразу, а спустя несколько часов или дней, действуя продолжительно.
92. Участники плазминовой системы:
а) плазмин и его профермент – плазминоген
б) активаторы плазминогена (тканевой активатор плазминогена, урокиназа)
в) проактиваторы плазминогена
г) ингибиторы плазмина (α2-антиплазмин, α2-макроглобулин, α1-антитрипсин)
д) ингибиторы активаторов плазминогена (ПАИ-1, ПАИ-2, ПАИ-3, ПАИ-4).
93. Плазминовая система:
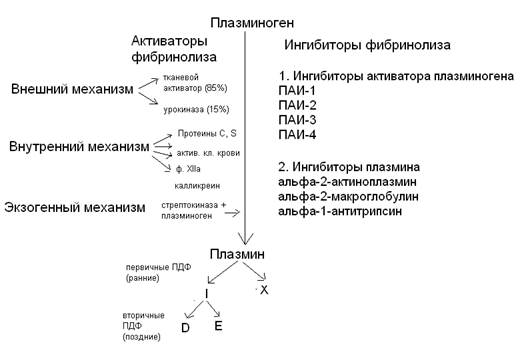
94. Активаторы плазминогена и их происхождение:
а) фактор Хагемана, прекалликреин, высокомолекулярный кининоген – белки крови
б) стрептокиназа – продуцируется β-гемолитическими стрептококками
в) урокиназа – продуцируется почечной тканью и эпителием мочевыводящих путей
г) тканевой активатор плазминогена – синтезируется эндотелием сосудов
д) кровяные активаторы плазминогена – содержатся в клетках крови (эритроциты, лейкоциты, тромбоциты)
95. Физиологические ингибиторы плазмина: α2-антиплазмин, α2-макроглобулин, α1-антитрипсин, антитромбин III, С1-инактиватор, интер-α2-антитрипсин.
96. Комплексные соединения гепарина, возникающие в крови при активации противосвертывающей системы, обратимы и диссоциируют, свободный гепарин образует комплекс с АТIII и усиливает его активность (до 1000 раз) ® ингибирование тромбина и других сериновых протеиназ ® препятствие свертыванию крови.
97. Нарушения в системе гемостаза могут привести к: 1) геморрагиям (кровотечениям) 2) тромбозам и тромбоэмболиям 3) тромбогеморрагическому синдрому (ДВС-синдрому)
Дата добавления: 2015-07-20; просмотров: 80 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Исследование белкового спектра крови. | | | Колобок — недопеченный бок_______________ |