
|
Читайте также: |
При секреции избыточных количеств основных гормонов коры надпочечников возникают четкие клинические синдромы. Так, избыточная продукция кортизола приводит к развитию синдрома Кушинга, избыточная продукция альдостерона — клинических и биохимических признаков альдостеронизма, а избыточная продукция андрогенов —к вирилизму надпочечникового генеза. Эти синдромы не всегда встречаются в «чистом» виде, и их проявления могут суммироваться.
Синдром Кушинга. Этиология. Синдром Кушинга характеризуется ожирением туловища, гипертензией, утомляемостью и слабостью, аменореей, гирсутизмом, фиолетовыми стриями на животе, отеками, глюкозурией, остеопорозом и базофильной опухолью гипофиза. Современная классификация синдрома Кушинга приведена в табл. 325-3. Независимо от причины, его вызывающей, синдром Кушинга всегда обусловливается усиленной продукцией кортизола надпочечниками. В большинстве случаев имеет место двусторонняя гиперплазия надпочечников, вызванная стимуляцией коркового слоя этих желез вследствие гиперсекреции гипофизарного АКТГ или продукции АКТГ опухолями других тканей. Частота гипофиззависимой гиперплазии надпочечников у женщин втрое выше, чем у мужчин, причем наиболее часто заболевание начинается на третьем-четвертом десятилетии жизни. Причина гиперсекреции АКТГ гипофизом все еще остается неясной, но, по всей вероятности, первичное нарушение локализуется в гипоталамусе или высших нервных центрах, что обусловливает секрецию КРГ в количествах, не соответствующих уровню кортизола в крови. Поэтому, чтобы снизить секрецию АКТГ до нормы, необходим более высокий уровень кортизола. Этот первичный дефект приводит к гиперстимуляции гипофиза и в некоторых случаях к образованию опухоли в нем. По мере роста опухоли гипофиза она может стать независимой от регуляторных влияний факторов центральной нервной системы и/или уровня кортизола в крови. Таким образом, у лиц с гиперсекрецией гипофизарного АКТГ может иметь место микроаденома (менее 10 мм) или макроаденома (более 10 мм) гипофиза либо диффузная гиперплазия кортикотропных клеток (гипоталамо-гипофизарная дисфункция). Поскольку микроаденомы гипофиза нередко трудно обнаружить обычными рентгенологическими способами, неизвестно, насколько часто аденомы служат причиной синдрома Кушинга. По традиции диагноз болезни Кушинга ставят только больным с АКТГ-продуцирующей опухолью гипофиза. Однако в ряде клинических центров этот диагноз устанавливают всем больным с гиперсекрецией гипофизарного АКТГ независимо от наличия у них опухоли. В данной главе мы пользуемся традиционным определением.
Опухоли неэндокринных тканей могут секретировать полипептиды, которые своими биологическими, химическими и иммунными свойствами не отличаются от АКТГ или КРГ и способны вызывать двустороннюю гиперплазию надпочечников (см. также гл. 303). Эктопическая продукция КРГ приводит к развитию клинических, биохимических и рентгенологических признаков, неотличимых от тех, которые вызываются гиперсекрецией гипофизарного АКТГ. При эктопической продукции АКТГ часто, но не всегда отсутствуют типичные признаки и симптомы синдрома Кушинга, а на первый план выступают гипокалиемический алкалоз и нарушение толерантности к глюкозе. В большинстве таких случаев речь идет о недифференцированном мелкоклеточном (овсяноклеточном) бронхогенном раке или об опухолях тимуса, поджелудочной железы или яичников, медуллярном раке щитовидной железы или бронхиальных аденомах. Синдром Кушинга, особенно у больных с овсяноклеточным раком легких, может возникать внезапно, и это отчасти объясняет отсутствие в таких случаях классических внешних признаков. С другой стороны, у больных с карциноидными опухолями или феохромоцитомами клиническая картина развивается в течение более длительного времени, и у них обычно имеются типичные кушингоидные черты. Секреция АКТГ опухолями неэндокринных тканей сопровождается накоплением в плазме фрагментов и предшественников этого гормона. Поскольку такие опухоли могут продуцировать большие количества АКТГ, базальная экскреция стероидов с мочой значительно возрастает и отмечается усиленная пигментация кожи. Действительно, гиперпигментация у больных с синдромом Кушинга почти всегда указывает на вненадпочечниковую опухоль, располагающуюся либо внутри, либо вне полости черепа.
Таблица 325-3. Причины синдрома Кушинга
I. Гиперплазия надпочечников
Вторичная по отношению к гиперпродукции АКТГ Гипофизарно-гипоталамическая дисфункция АКТГ-продуцирующие микро- или макроаденомы гипофиза Вторичная по отношению к АКТГ- или КРГ-продуцирующим опухолям неэндокринных тканей (бронхогенный рак, карциноид тимуса, рак поджелудочной железы, аденома бронхов)
II. Узелковая гиперплазия надпочечников
III. Новообразования надпочечников Аденома Рак
IV. Экзогенные, ятрогенные причины
Длительное применение глюкокортикоидов Длительное применение АКТГ
Приблизительно у 20—25% больных с синдромом Кушинга имеется первичная гиперпродукция кортизола и других стероидов, обусловленная надпочечниковым новообразованием. Эти опухоли развиваются обычно лишь на одной из сторон, и примерно половина из них — злокачественные. Иногда у больных выявляются биохимические признаки как гиперсекреции гипофизарного АКТГ, так и аденомы надпочечников. В таких случаях обнаруживаются обычно микро- или макроузелковые изменения в обоих надпочечниках, определяющие узелковую гиперплазию.
Наиболее частая причина синдрома Кушинга — это ятрогенное введение стероидов по другим поводам. Хотя клиническая картина синдрома в этих случаях имеет некоторое сходство с таковой у лиц, страдающих аденомой надпочечников, анамнез и первые лабораторные исследования позволяют без труда выделить таких больных.
Клинические признаки, симптомы и лабораторные да иные. О многих признаках и симптомах синдрома Кушинга можно догадаться, исходя из знаний эффектов глюкокортикоидов (табл. 325-4). Вследствие мобилизации периферических опорных тканей возникают мышечная слабость и утомляемость, остеопороз, кожные стрии и кровоподтеки. Два последних признака обусловливаются слабостью и разрывами коллагеновых волокон в коже. Остеопороз может быть настолько выраженным, что приводит к компрессии тел позвонков и переломам других костей. В результате усиления гликонеогенеза в печени и инсулинорезистентности нарушается толерантность к глюкозе. Явный диабет встречается менее чем у 20% больных, у которых, вероятно, имеется семейная предрасположенность к этому заболеванию. Избыток кортизола способствует отложению жировой ткани в характерных местах, особенно в верхней части лица (классическое лунообразное лицо), в межлопаточной области («бычий горб»), а также в мезентериальном ложе, что определяет классическое «туловищное» ожирение (рис. 325-6). Изредка жировые отложения появляются над грудиной, и из-за накопления жира увеличивается медиастинальное пространство. Причины такого своеобразного распределения жировой ткани неясны. Лицо кажется полнокровным, даже если концентрация эритроцитов не повышена. Часто встречаются гипертензия, а также глубокие эмоциональные нарушения — от раздражимости или эмоциональной неустойчивости до тяжелой депрессии, помешательства или даже явных психозов. У женщин повышенная секреция надпочечниковых андрогенов может вызывать образование угрей, гирсутизм и олиго- или аменорею. Наиболее частые признаки и симптомы у больных с гиперкортицизмом, такие как ожирение, гипертензия, остеопороз и диабет, достаточно неспецифичны и поэтому мало помогают диагностике данного заболевания. С другой стороны, легкая травмируемость, типичные стрии, миопатия и андрогенные эффекты (встречающиеся, однако, реже), если они присутствуют, служат более надежными признаками синдрома Кушинга.
За исключением случаев ятрогенного синдрома Кушинга содержание кортизола в плазме и 17-гидроксикортикоидов в моче при этом заболевании в той или иной степени повы-
Таблица 325-4. Частота признаков и симптомов при синдроме Кушинга (%)
| Типичный внешний вид | Аменорея | ||
| Увеличение массы тела | Кожные стрии | ||
| Утомляемость и слабость | Изменения личности | ||
| Гипертензия (более 150/90 мм рт. ст | Экхимозы | ||
| Гирсутизм | Отеки | ||
| Полиурия, полидипсия | |||
| Гипертрофия клитора |
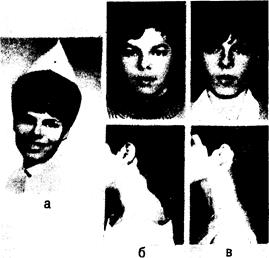
Рис. 325-6. Женщина в возрасте 20 лет с синдромом Кушинга на почве аденомы коры правого надпочечника. а — за 2 года до операции (в возрасте 18 лет); б — за 1 мес до операции (в возрасте 20 лет); в — через 1 год после операции (в возрасте 21 года).
шено. Иногда имеют место гипокалиемия, гипохлоремия и метаболический алкалоз, особенно у больных с эктопической продукцией АКТГ.
Диагностика. Диагноз синдрома Кушинга ставят тем больным, у которых повышена продукция кортизола, и невозможно нормально подавить его секрецию при введении дексаметазона. После установления диагноза проводят пробы, позволяющие выяснить этиологию избытка кортизола (рис. 325-7 и табл. 325-5).
Для первоначального скрининга рекомендуется ночной супрессивный тест с дексаметазоном (см. выше). В сложных случаях (например, при ожирении) в качестве скрининг-теста прибегают также к определению суточной экскреции свободного кортизола. Экскреция выше 100 мкг в сутки говорит в пользу синдрома Кушинга. Затем, если после стандартного «малого» супрессивного теста с дексаметазоном (0,5 мг каждые 6 ч в течение 48 ч) уровень кортизола в моче не падает ниже 30 мкг в сутки, содержание кортизола в плазме — ниже 5 мкг/дл (50 мкг/л) или экскреция 17-гидроксистероидов — ниже 3 мг/24 ч, устанавливают окончательный диагноз. Разобщенное определение уровней кортизола, а также АКТГ в плазме крови малоинформативно из-за их суточных колебаний, хотя данные об отсутствии нормального их снижения перед сном имеют определенную пользу.
Выяснение причины синдрома Кушинга затруднено неспецифичностью всех существующих тестов, а также спонтанными изменениями секреции гормонов, часто весьма резкими, которые могут возникать при вызывающих этот синдром опухолях (периодический гормоногенез). Специфичность ни одного из тестов не превышает 95%, и для установления правильного диагноза может потребоваться сочетание нескольких тестов. На первом этапе особенно целесообразно оценить реакцию экскреции кортизола на введение большой дозы дексаметазона (2 мг каждые 6 ч в течение 2 дней). Результаты большинства исследований свидетельствуют о том, что более чем у половины больных при проведении этого теста содержание кортизола и/или 17-гидроксистероидов в моче падает ниже 50% от исходного уровня. У таких больных обычно имеется либо АКТГ-секретирующая микроаденома гипофиза, либо гипоталамо-гипофизарная дисфункция. Иногда выведение стероидов резко падает и у больных с двусторонней узелковой гиперплазией надпочечников и/ или эктопической продукцией КРГ. Отсутствие выраженного снижения продукции кортизола после введения малых или больших доз дексаметазона характерно обычно для больных с гиперплазией надпочечников, обусловленной АКТГ-секретирующей макроаденомой гипофиза или АКТГ-продуцирующей опухолью неэндокринного происхождения, а также для больных с опухолями надпочечников (см. табл. 325-5).
Теоретически для разграничения различных причин синдрома Кушинга, особенно для АКТГ-зависимых и АКТГ-независимых его форм, полезно было бы определять уровень АКТГ в плазме крови. При АКТГ-независимых формах это, как правило, так и есть, поскольку большинство опухолей надпочечников характеризуется низким или даже неопределимым уровнем АКТГ. Более того, АКТГ-секретирующие макроаденомы гипофиза и АКТГ-продуцирующие неэндокринные опухоли обычно характеризуются повышенными уровнями АКТГ. Однако ориентироваться на уровень АКТГ в дифференциальной диагностике синдрома Кушинга мешают по меньшей мере два обстоятельства. Во-первых, надежные методы определения АКТГ до сих пор еще доступны не повсеместно, а во-вторых, у больных с гипоталамо-гипофизарной дисфункцией, микроаденомой гипофиза, эктопической продукцией КРГ и продукцией АКТГ некоторыми неэндокринными опухолями (особенно карциноидными) уровни АКТГ могут быть близкими по значению (см. табл. 325-5).
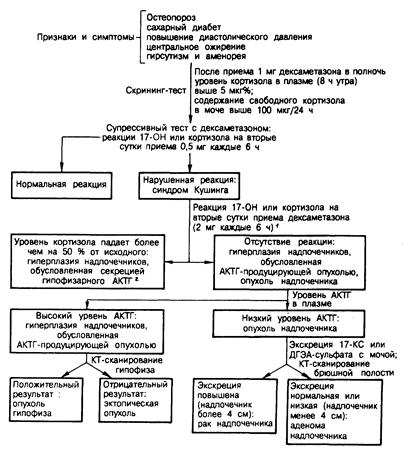
Рис. 325-7. Диагностическая схема, применяемая при обследовании больных с подозрением на синдром Кушинга.
1 Вместо «большого» дексаметазонового теста (2 мг внутрь каждые 6 ч) можно оценивать реакцию 17-гидроксикортикостероидов на метопирон (750 мг внутрь каждые 4 ч, 6 доз). У большинства больных с гиперплазией надпочечников, обусловленной гиперсекрецией гипофизарного АКТГ, экскреция 17- гид-роксикортикостероидов с мочой после приема метопирона повышается; отсутствие реакции указывает на новообразование надпочечников или их гиперплазию, обусловленную АКТГ-продуцирующей опухолью неэндокринной ткани.
2 Эта группа включает, вероятно, больных как с гипоталамо-гипофизарной дисфункцией, так и с микроаденомами гипофиза. В некоторых случаях микроаденому гипофиза удается визуализовать с помощью КТ-сканирования турецкого седла.
Эти трудности заставляют применять некоторые дополнительные тесты, например пробы с введением метопирона и КРГ. Оба они имеют сходное теоретическое обоснова
Таблица 325-5. Диагностические тесты для определения типа синдрома Кушинга
| Показатель | Макроаденома гипофиза | Гипоталамо-гипофизарная дисфункция или микроаденома | Эктопическая продукция АКТГ или КРГ | Опухоль надпочечника |
| Уровень АКТГ в плазме | — | Н— | . — | ¯ |
| Реакции на высокую дозу дексаметазона, % | <10 | >80 | <10 | <10 |
| Реакция на метопирон,% | >80 | >90 | <10 | <10 |
| Реакция на КРГ, % | >90 | >90 | <10 | <10 |
Обозначения:Н — норма, — повышение, ¯. — снижение.
ние: гиперсекреция стероидов, обусловленная опухолью надпочечников или эктопической секрецией АКТГ, должна подавлять гипоталамо-гипофизарную ось, и в результате с помощью каждого из этих тестов можно выявить ингибирование гипофизарной секреции АКТГ. Действительно, большинство больных с гипоталамо-гипофизарной дисфункцией и/или микроаденомой гипофиза реагируют на введение метопирона и КРГ повышением секреции стероидов или АКТГ, тогда как у большинства больных с эктопическими АКТГ-продуцирующими опухолями и опухолями надпочечников этого не происходит. Реакция на КРГ отмечается и у большинства пациентов с макроаденомами гипофиза, но реакция на метопирон у них непостоянна. Однако целесообразность проведения инфузионного теста с КРГ остается неясной, поскольку он при менялся лишь в ограниченном числе исследований.
Главная проблема, возникающая при диагностике синдрома Кушинга, заключается в том, чтобы разграничить больных с микроаденомой гипофиза, эктопической продукцией КРГ, эктопической продукцией АКТГ некоторыми параэндокринными опухолями (например, карциноидами или феохромоцитомой) и гипофизарной дисфункцией гипоталамического генеза. В большинстве всех этих случаев на КТ-сканограмме гипофиза не обнаруживают какой-либо патологии. Сходны и клинические проявления, если только эктопические опухоли не вызывают других симптомов, таких как понос и приливы к лицу при карциноидных опухолях или приступы гипертонии при феохромоцитоме. Иногда, как отмечалось выше, эктопическую продукцию АКТГ удается отличить от гипофизарной с помощью тестов с метопироном или КРГ. В некоторых клиниках для того, чтобы убедиться, что источник гиперпродукции АКТГ локализуется именно в гипофизе, определяют разницу концентраций АКТГ в крови каменистой пазухи и периферической крови. Особенно трудно разграничить гипоталамо-гипофизарную дисфункцию и опухоли, продуцирующие КРГ; если эктопическая опухоль не видна или если она не продуцирует других гормонов, то надежных способов дифференциации нет.
Диагноз кортизолпродуцирующей аденомы надпочечника предполагают на основании непропорционального повышения фоновой экскреции 17-гидроксистероидов или свободного кортизола с мочой и лишь небольших колебаний уровня 17-кетостероидов в моче или ДГЭА-сульфата в плазме крови. У таких больных секреция андрогенов надпочечниками обычно снижена, поскольку избыток кортизола подавляет секрецию АКТГ с последующей инволюцией вырабатывающей андрогены сетчатой зоны.
Диагноз рака надпочечников предполагают при наличии в брюшной полости пальпируемой опухоли и значительного повышения фоновых уровней как 17-гидроксистероидов в моче, так и ДГЭА-сульфата в плазме. Содержание кортизола в плазме и моче в той или иной степени повышено. Рак надпочечников обычно резистентен и к стимуляции АКТГ, и к ингибированию дексаметазоном. У женщин выраженное повышение секреции надпочечниковых андрогенов часто вызывает вирилизацию. Феминизирующая эстрогенпродуцирующая карцинома коры надпочечников у мужчин обычно проявляется гинекомастией. Эти надпочечниковые опухоли секретируют чрезмерные количества андростендиона, который на периферии превращается в эстрогены — эстрон и эстрадиол (см. гл. 332). Функционирующие раки надпочечников, вызывающие синдром Кушинга, чаще всего характеризуются повышенными уровнями промежуточных продуктов биосинтеза стероидов (особенно 11-дезоксикортизола), что указывает на недостаточность превращения интермедиатов в конечный продукт. Важно также помнить, что в 20% случаев раки надпочечников не сопровождаются эндокринными синдромами и, как считают, либо являются нефункционирующими, либо продуцируют биологически неактивные стероидные предшественники. Наконец, в некоторых условиях чрезмерная продукция половых стероидов остается нераспознанной (например, избыточная секреция андрогенов у взрослых мужчин).
Дифференциальная диагностик а. Псевдосиндром Кушинга. Диагностические трудности возникают при обследовании больных с ожирением, хроническим алкоголизмом, психической депрессией и острой патологией любого типа. Резкое ожирение при синдроме Кушинга встречается редко; более того, при экзогенном ожирении жировая ткань распределяется относительно равномерно, а не локализуется только на туловище. При исследовании функции коры надпочечников у больных с экзогенным ожирением обычно выявляются лишь небольшие нарушения. Фоновая экскреция стероидов с мочой у пациентов с избыточной массой тела либо нормальна, либо слегка повышена; аналогичные данные имеются и о секреции кортизола. У некоторых больных ускоряется превращение секретируемого кортизола в экскретируемые метаболиты. Уровень кортизола в моче и крови остается нормальным; не нарушается и суточный ритм его уровня в крови и моче. Экзогенное ожирение может быть причиной изменений секреции и метаболизма стероидов; это подчеркивает вторичность возможных нарушений стероидных тестов. У лиц, страдающих хроническим алкоголизмом и депрессией, имеются сходные сдвиги в выведении стероидов: повышение уровня 17-гидроксистероидов в моче, отсутствие суточного ритма концентраций кортизола и резистентность к ингибирующему эффекту дексаметазона (особенно при ночном и малом тесте). В отличие от страдающих алкоголизмом у больных с психической депрессией признаки синдрома Кушинга отсутствуют. После отказа от алкоголя и/или улучшения эмоционального состояния результаты стероидных тестов нормализуются. У таких больных в отличие от лиц с синдромом Кушинга сохранена нормальная реакция кортизола на инсулиновую гипогликемию. У лиц с острыми заболеваниями при лабораторных исследованиях часто выявляют нарушения, и, кроме того, отсутствует подавление дексаметазоном, поскольку тяжелый стресс (такой как боль или лихорадка) отрицательно влияет на нормальную регуляцию секреции АКТГ. Внешние признаки ятрогенного синдрома Кушинга, вызванного введением сильных синтетических глюкокортикоидов, сходны с таковыми при эндогенной гиперфункции коры надпочечников. Выделить таких больных можно, лишь определив уровень кортизола в крови и моче или фоновую экскрецию 17-гидроксистероидов; все эти показатели снижены из-за ингибирования гипофизарно-надпочечниковой оси. Степень тяжести ятрогенного синдрома Кушинга определяется общей дозой вводимых стероидов, биологическим периодом полураспада стероидного препарата и продолжительностью его введения. Улиц, получающих стероиды во второй половине дня или вечером, синдром Кушинга развивается быстрее и при меньших суточных дозах экзогенных препаратов, чем у больных, стероидная терапия которых ограничена только утренними дозами. Разные больные характеризуются также неодинаковой активностью ферментов деградации введенных стероидов и их связывания.
Лучевые исследования при синдроме Кушинга. Лучшим рентгенологическим способом визуализации надпочечников является компьютерная томография (КТ-сканирование) области живота (рис. 325-8). Эта методика во многом вытеснила ранее применявшиеся инвазивные приемы (такие как селективная артериография и венография надпочечников), а также сканирование с 19-[131I]-йодхолестерином; с помощью КТ-сканирования удается не только определить локализацию опухоли надпочечников, но и отличить их от двусторонней гиперплазии. У всех больных с подозрением на гиперсекрецию гипофизарного АКТГ следует проводить КТ-сканирование гипофиза с контрастным средством, чтобы подтвердить наличие опухоли гипофиза. Однако даже с помощью лучших из существующих в настоящее время компьютерных томографов не всегда можно обнаружить небольшие микроаденомы.
Исследование бессимптомных новообразований в надпочечниках. При КТ-сканировании области живота часто случайно обнаруживают надпочечниковые новообразования. Это и неудивительно, так как аденомы коры надпочечни
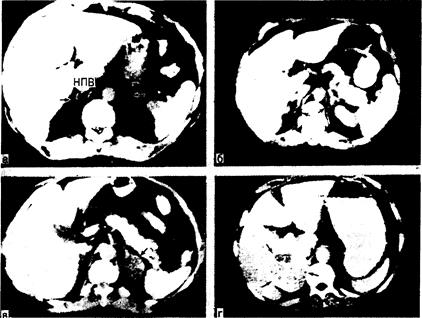
Рис. 325-8. Компьютерная томография—лучший метод визуализации надпочечников (надпочечники показаны стрелками). а — нормальный правый надпочечник прилежит к нижней полой вене (НПВ) у мести ее отхождения от печени. Примерно в 90% случаев правый надпочечник выглядит как линейная структура, тянущаяся кзади от нижней полой вены в пространство между правой долей печени и ножкой диафрагмы. Нормальный левый надпочечник лежит латерально от левой ножки диафрагмы и ниже желудка. Левый надпочечник в большинстве случаев по форме напоминает перевернутые буквы «V» или «Y»; б — КТ-сканограмма надпочечников у больного с эктопической продукцией АКТГ. Оба надпочечника (стрелки) увеличены по сравнению с изображенными на снимке а. В отличие от этого увеличение надпочечников при КТ-сканировании выявляется лишь у 50% больных с двусторонней гиперплазией этих желез, обусловленной гиперсекрецией гипофизарного АКТГ; в — КТ-сканограмма больного с синдромом Кушинга и биохимическими признаками гиперпродукции только кортизола. Левый надпочечник замещен опухолью диаметром 2 см, по форме напоминающей ракетку (стрелка). Опухоль плохо контрастируется, так как содержит много липидов; г — КТ-сканограмма больного с синдромом Кушинга и биохимическими признаками рака надпочечников. В отличие от изображения на снимке расположенная слева масса выглядит неравномерной и имеет большие размеры — характерные особенности рака надпочечников.
ков при вскрытии выявляются у 10—20% людей. При обследовании таких лиц прежде всего нужно с помощью соответствующих скрининг-тестов выяснить, функционируют ли эти опухоли. Однако в 90% случаев опухоли, случайно выявляемые при КТ-сканировании области живота, оказываются нефункционирующими. К счастью, они редко бывают и злокачественными. Тем не менее нефункционирующие опухоли ставят перед врачом ряд трудных вопросов. Так как 20%) раков надпочечников — нефункционирующие опухоли, следовало бы считать, что их всегда нужно удалять. Однако частота рака надпочечников по сравнению с частотой доброкачественных аденом коркового слоя низка (менее 1%), и в большинстве случаев хирургическая операция не показана. Иногда имеет значение размер опухоли: раковая опухоль надпочечников редко имеет диаметр менее 3 см, а надпочечниковые аденомы обычно не достигают 6 см (см. рис. 325-8). Если операцию не проводят, как правило, показано повторное КТ-сканирование через 3—6 мес.
Лечение. Опухоли надпочечников. Если установлен диагноз аденомы или рака надпочечников, опухоль удаляют. Из-за возможной атрофии второго надпочечника больного как до операции, так и после нее следует лечить, как при полной адреналэктомии, даже в том случае, если предполагают, что процесс односторонний; методика лечения сходна с таковой для больных с аддисоновой болезнью, подвергающихся оперативному вмешательству (см. табл.325-11).
Несмотря на хирургическую операцию, большинство больных с раком надпочечников погибают в течение 3 лет после установления диагноза. Метастазы чаще всего обнаруживаются в печени и легких. Основное противоопухолевое средство, используемое при лечении больных с метастазирующим раком надпочечников, — это хлодитан (о, p'-DDD) — изомер инсектицида ДДТ. Хлодитан подавляет продукцию кортизола и снижает уровень стероидов в плазме крови и моче. Хотя его цитотоксический эффект относительно избирателен для зоны коры надпочечников, секретирующей глюкокортикоиды, клубочковая зона тоже может быть ингибирована. Поскольку хлодитан меняет и вненадпочечниковый метаболизм кортизола, эффективность препарата следует оценивать по уровню кортизола в плазме и моче. Дозу хлодитана обычно дробят на 3—4 приема в день, постепенно увеличивая ее до 8—10 г в сутки. Почти у всех больных возникают побочные эффекты со стороны желудочно-кишечного тракта (анорексия, понос или рвота) или нервно-мышечной системы (ступор, сонливость или головокружение). Все больные, получающие хлодитан, должны находиться на длительной поддерживающей глюкокортикоидной терапии, причем следует вводить и определенные заместительные дозы минералокортикоидов. Примерно у 30% больных как опухоль, так и метастазы подвергаются регрессии, но, как уже отмечалось, долговременный прогноз неблагоприятный. У многих больных хлодитан только ингибирует стероидогенез, не вызывая регрессии метастазов опухоли. Костные метастазы обычно рефрактерны по отношению к препарату, и их следует подвергать облучению. Хлодитан можно применять и в качестве дополнительного средства после хирургической резекции рака надпочечников, даже при отсутствии видимых метастазов, поскольку прогноз этой опухоли столь неблагоприятен.
Двусторонняя гиперплазия.
У больных с гиперплазией имеет место относительное или абсолютное повышение уровня АКТГ. Поскольку терапия должна быть направлена на снижение этого уровня, идеальным способом основного лечения при АКТГ- или КРГ-продуцирующих опухолях, будь то гипофизарных или эктопических, является их хирургическое удаление. Иногда из-за чрезмерной запущенности болезни, особенно при эктопической продукции АКТГ, этого сделать невозможно. В таких случаях для коррекции избытка кортизола может быть показана «медикаментозная» или хирургическая адреналэктомия.
Мнения по поводу лечения при двусторонней гиперплазии надпочечников, когда источник гиперпродукции АКТГ остается неясным, противоречивы. В некоторых клиниках у таких больных (особенно при положительном результате «большого» теста с дексаметазоном) производят интраоперационное исследование гипофиза через транссфеноидальный доступ в надежде обнаружить микроаденому. Эти исследования оказываются успешными в 20—70% случаев в зависимости от опытности хирурга и способности рентгенолога до операции определить локализацию микроаденомы. Однако в том случае, если микроаденома не обнаружена, может потребоваться полная гипофизэктомия. Осложнения транссфеноидальной операции включают ринорею, несахарный диабет, пангипопитуитаризм и повреждение зрительных или других черепных нервов. Больше того, такие новообразования гипофиза могут рецидивировать, если первичное нарушение локализуется в гипоталамусе.
В других клиниках средством выбора считают полную адреналэктомию. Эффективность такого подхода близка к 100%, однако он сопряжен с необходимостью пожизненной минералокортикоидной и глюкокортикоидной заместительной терапии и вероятность развития у 10—20% больных опухоли гипофиза в ближайшие 10 лет, что часто требует хирургического лечения (синдром Нельсона). Неясно, развивается ли опухоль у таких больных de novo (см. гл. 321) или к моменту оперативного вмешательства она уже имелась, но была столь мала, что не выявлялась рентгенологически. У каждого больного, перенесшего двустороннюю адреналэктомию по поводу синдрома Кушинга, следовало бы периодически проверять состояние гипофиза с помощью КТ-сканирования и производить серийные определения уровня АКТГ. Опухоли гипофиза, которые выявляются после адреналэктомии, часто приобретают способность к местной инвазии и сдавливают перекрест зрительных нервов или распространяются в пещеристые или сфеноидальные синусы. Поэтому радикальный хирургический подход нередко требует послеоперационного облучения.
В отдельных клиниках больных с гиперпродукцией гипофизарного АКТГ лечат в основном облучением гипофиза, используя либо обычные наружные, либо альфа-излучатели (протоновый пучок). Последний способ, хотя и более эффективный, чаще вызывает паралич глазодвигательных нервов и гипопитуитаризм, чем обычная лучевая терапия. Длительный латентный период между лечением и ремиссией, а также тот факт, что частота ремиссий составляет менее 50%, часто выдвигают в качестве аргументов против использования внешнего облучения гипофиза для терапии быстро прогрессирующего или тяжелого синдрома Кушинга.
Наконец, у отдельных больных, у которых невозможно провести хирургическую операцию, снижения секреции кортизола можно добиться с помощью медикаментозного лечения, направленного на подавление секреции гипоталамического КРГ: введение либо антагониста серотонина—ципрогептадина, либо ингибитора трансаминазы ГАМК—вальпроата натрия (Sodium valproate). У некоторых больных секрецию АКТГ подавляет и дофаминергический агонист бромокриптин.
Если ни один из перечисленных методов лечения не приводит к снижению уровня АКТГ, то могут возникнуть показания к медикаментозной или хирургической адреналэктомии (табл. 325-6). Химическую адреналэктомию обеспечивает введение хлодитана (2—3 г в день) и/или аминоглютетимида (1 г в день) и метопирона (2—3 г в день).
Альдостеронизм. Альдостеронизм — это синдром, обусловленный гиперсекрецией главного надпочечникового минералокортикоида—альдостерона. Первичный альдостеронизм означает, что стимул к чрезмерной продукции альдостерона локализуется в самих надпочечниках; при вторичном альдостеронизме такой стимул находится вне надпочечников.
Первичный альдостеронизм. Признаки и симптомы чрезмерной и неадекватной продукции альдостерона были впервые суммированы Конном в 1956 г. Часто болезнь является результатом альдостеронпродуцирующей аденомы надпочечников (синдром Конна). В большинстве случаев имеет место односторонняя аденома, обычно небольших размеров, встречающаяся с равной частотой с обеих сторон. Изредка первичный альдостеронизм обусловлен раком надпочечников. Женщины заболевают в 2 раза чаще, чем мужчины, поражаются, как правило, лица в возрасте от 30 до 50 лет. Первичный альдостеронизм выявляют примерно у 1% общей популяции больных с гипертензией. У многих больных с клиническими и биохимическими признаками, характерными для первичного альдостеронизма, при операции обнаруживают не солитарную аденому, а двустороннюю узелковую гиперплазию коркового слоя. В литературе это состояние называют по-разному: «псевдо»-первичным альдостеронизмом, идиопатическим альдостеронизмом или узелковой гиперплазией. Причина заболевания неизвестна.
Признаки и симптомы. Вследствие постоянной гиперсекреции альдостерона в дистальных отделах почечных канальцев увеличивается обмен содержащегося в просвете канальца натрия на секретируемые ионы калия и водорода, что приводит к прогрессирующему обеднению организма калием и гипокалиемии. У большинства больных имеется незначительная диастолическая гипертензия, они жалуются на головные боли. Гипертензия обусловлена, вероятно, повышенной реабсорбцией натрия и увеличением внеклеточного объема. Уменьшение запасов калия лежит в основе мышечной слабости и утомляемости, определяя возникновение эффектов калиевого дефицита внутри и вне клетки на мышечную мембрану. В результате нарушения способности концентрировать мочу развивается полиурия, часто сопровождающаяся полидипсией. Повышение артериального давления обусловливает электрокардиографические и рентгенографические признаки увеличения левого желудочка сердца. Часто наблюдаются электрокардиографические признаки дефицита калия, такие как появление выраженной волны U, сердечные аритмии и экстрасистолы. Если нет сопутствующей застойной сердечной недостаточности, поражения почек или предсуществующих заболеваний (таких как тромбофлебит), отеки обычно отсутствуют. Однако при длительном альдостеронизме может развиться нефропатия с азотемией, сопровождающаяся застойной сердечной недостаточностью и отеками.
Таблица 325-6. Виды лечения больных с гиперплазией надпочечников, обусловленной гиперсекрецией гипофизарного АКТГ
I. Снижение продукции АКТГ гипофизом
Транссфеноидальная резекция микроаденомы Облучение
Лечение антагонистом гипоталамического серотонина (ципрогептадин) или ингибитором ГАМК-трансаминазы (вальпроат натрия)1
II. Снижение или ликвидация секреции кортизола корой надпочечников Двусторонняя адреналэктомия Медикаментозная адреналэктомия (метопирон, хлодитан, аминоглютетимид)
1 Не излечивают, но у специально отобранных больных эффективны в течение всего срока хронического введения.
Лабораторные данные. Лабораторные данные зависят как от длительности, так и от тяжести потерь калия. Ночной концентрационный тест часто выявляет нарушение способности концентрировать мочу. Моча имеет нейтральный или щелочной рН, поскольку в качестве меры компенсации метаболического алкалоза в нее секретируются избыточные количества ионов аммония и бикарбоната. Показатели секреции глюкокортикоидов и андрогенов остаются в нормальных пределах.
Гипокалиемия может быть весьма тяжелой (менее 3 мэкв калия на 1 л) и отражает значительную потерю калия организмом, превышающую обычно 300 мэкв. Гипернатриемия обусловливается как задержкой натрия, так и одновременной потерей воды из-за полиурии. Метаболический алкалоз и повышение уровня бикарбоната в сыворотке крови являются результатом потери ионов водорода с мочой и их переходом в обедненные калием клетки. Алкалоз поддерживается дефицитом калия, в условиях которого возрастает способность проксимальных извитых канальцев реабсорбировать фильтруемый бикарбонат. При тяжелой гипокалиемии снижается и уровень магния в сыворотке крови. В отсутствие азотемии содержание мочевой кислоты в сыворотке остается нормальным.
Общее содержание натрия в организме и общее количество обменивающегося натрия возрастает, тогда как общее количество обменивающегося калия обычно снижается. Увеличение внеклеточного объема жидкости может извращать суточный ритм экскреции соли и воды с преимущественным выведением их из организма в ночные часы.
Диагностика. Предположительный диагноз устанавливают, обнаружив постоянную гипокалиемию у больного без отеков, потребляющего нормальные количества натрия, в отсутствие приема снижающих (фуросемид, этакриновая кислота, тиазиды) или сберегающих калий (триамтерен, спиронолактон) диуретиков. Если гипокалиемию выявляют у больных с гипертензией, получающих снижающие содержание калия диуретики, прием их следует прекратить и увеличить количество калия, поступающего в организм с пищей. Через 1—2 нед необходимо повторно определить уровень калия, и если гипокалиемия сохраняется, больного нужно обследовать на предмет синдрома избытка минералокортикоидов (рис. 325-9).
Критерии диагноза первичного альдостеронизма включают: 1) диастолическую гипертензию в отсутствие отеков, 2) сниженную секрецию ренина (о чем говорит низкая активность ренина плазмы) без тенденции к адекватному возрастанию в условиях уменьшения объема (ортостаз, ограничение натрия) и 3) гиперсекрецию альдостерона, которая недостаточно снижается в условиях увеличения объема (солевая нагрузка).
У больных с первичным альдостеронизмом отеки, как правило, отсутствуют вследствие проявления у них феномена «ускользания» от натрийзадерживающего эффекта минералокортикоидов. Изредка при наличии нефропатии и азотемии наблюдается претибиальный отек.
Хотя сниженная секреция ренина (отсутствие нормального прироста активности ренина плазмы в условиях снижения объема жидкости) — это диагностический критерий первичного альдостеронизма, определение активности ренина плазмы не может помочь отдифференцировать больных с первичным альдостеронизмом от тех, у кого гипертензия вызвана другими причинами, так как снижение активности ренина плазмы обнаруживают и у 25% больных с гипертонической болезнью. В этой связи для подтверждения диагноза первичного альдостеронизма необходимо убедиться в том, что отсутствует подавление секреции альдостерона (см. рис. 325-9). Автономия, проявляемая альдостеронпродуцирующими опухолями у таких больных, касается только резистентности к подавляющему секрецию эффекту увеличения объема жидкости; на стимуляцию нагрузкой калия или инфузией АКТГ эти опухоли отвечают нормальной или даже усиленной реакцией.
Если снижение секреции ренина и отсутствие подавления секреции альдостерона подтверждено, следует еще до операции определить локализацию альдостеронпродуцирующей аденомы с помощью либо КТ-сканирования области живота, либо чрескожной трансфе
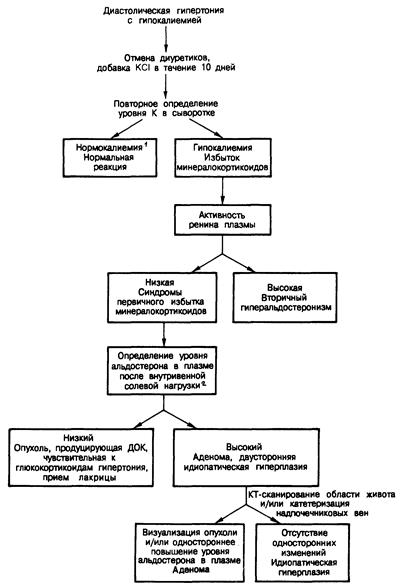
Рис. 325-9. Диагностическая схема, применяемая при обследовании больных с подозрением на первичный альдостеронизм.
1 У некоторых больных с гиперальдостеронизмом, принимающих калийсберегающие диуретики (спиронолактон, триамтерен) или получающих бедную натрием и богатую калием диету, уровень калия в сыворотке крови может быть нормальным.
2 Этот этап диагностики не следует проводить у больных с тяжелой гипертензией (диастолическое давление выше 115 мм рт. ст.) или при наличии сердечной недостаточности. До инфузии солевого раствора следует нормализовать и уровень калия в сыворотке. К альтернативным способам индукция сравнимого снижения секреции альдостерона относятся пероральная нагрузка натрием (200 мэкв в день на протяжении 3 дней) или внутримышечное введение каждые 12 ч в течение 3 дней 10 мг дезоксикортикостерона ацетата (ДОКА).
моральной двусторонней катетеризации надпочечниковых вен с одновременной венографией. Последняя методика позволяет рентгенологически локализовать аденому. Кроме того, исследуя кровь из надпочечниковых вен, можно убедиться в 2—3-кратном увеличении концентрации альдостерона на пораженной стороне по отношению к здоровой. При гиперальдостеронизме, обусловленном узелковой гиперплазией коркового слоя, различий в концентрации альдостерона нет. Важно брать пробы крови с обеих сторон одновременно, а также определять в них уровень кортизола, чтобы избежать ошибки в локализации, связанной с влиянием АКТГ или стресса на содержание альдостерона.
Дифференциальная диагностик а. У больных с гипертензией и гипокалиемией альдостеронизм может быть как первичным, так и вторичным (см. рис. 325-10). Дифференцировать эти состояния помогает определение активности ренина плазмы. Гиперсекреция альдостерона у больных с быстро развивающейся гипертензией и вторичным альдостеронизмом обусловлена повышением уровня ренина в плазме, тогда как у больных с первичным альдостеронизмом уровень ренина в плазме снижен.
Первичный альдостеронизм нужно отличать также от других гиперминералокортикоидных состояний. Трудность часто заключается в разграничении гиперальдостеронизма на почве аденомы и вследствие идиопатической двусторонней узелковой гиперплазии. Это важно, поскольку гипертензия, обусловленная идиопатической гиперплазией, обычно не исчезает после двусторонней адреналэктомии, тогда как гипертензия, связанная с альдостеронпродуцирующими опухолями, как правило, смягчается или полностью исчезает после удаления аденомы. Хотя у больных с идиопатической двусторонней узелковой гиперплазией гипокалиемия часто выражена слабее, секреция альдостерона ниже, а активность ренина плазмы выше, чем у больных с первичным альдостеронизмом, дифференциальная диагностика на основании только клинических и/или биохимических данных невозможна. У большинства больных с односторонним процессом имеют место аномальное постуральное снижение уровня альдостерона и повышение содержания 18-гидроксикортикостерона в плазме, но диагностическое значение этих показателей в каждом отдельном случае также ограничено. Как отмечалось выше, окончательный диагноз лучше всего базировать на рентгенологических данных.
В отдельных случаях у больных с гипертензией и гипокалиемическим алкалозом обнаруживают аденомы, секретирующие дезоксикортикостерон (ДОК). Такие больные характеризуются сниженной активностью ренина в плазме, но содержание альдостерона у них либо нормально, либо снижено. Это говорит в пользу избытка не альдостерона, а другого гормона, обладающего минералокортикоидным действием. В редких случаях гиперминералокортицизм обусловлен нарушением биосинтеза кортизола, в частности 11- или 17-гидроксилирования. Уровень АКТГ при этом повышен, в результате чего увеличивается продукция минералокортикоида 11-дезоксикортикостерона. В таких случаях гипертензию и гипокалиемию удается ликвидировать введением глюкокортикоидов. Окончательный диагноз устанавливают на основании повышения уровня предшественников биосинтеза кортизола в крови или моче. Иногда введение глюкокортикоидов нормализует артериальное давление и калиемию даже тогда, когда не удается обнаружить недостаточность гидроксилаз (см. рис. 325-9).
Леденцы или жевательный табак, содержащие некоторые формы лакрицы, вызывают синдром, напоминающий первичный альдостеронизм. Задерживающим натрий веществом в таких продуктах служит глицирризиновая кислота, способная вызывать увеличение объема внеклеточной жидкости, гипертензию, снижение уровня ренина и содержания альдостерона в плазме. Диагноз устанавливают или исключают на основании тщательной оценки данных анамнеза.
Лечение. Больным с первичным альдостеронизмом, обусловленным аденомой, показано хирургическое лечение. Однако во многих случаях достаточно ограничить потребление натрия в диете и вводить антагонист альдостерона— спиронолактон. Гипертензию и гипокалиемию удается купировать назначением спиронолактона в дозах 25— 100 мг каждые 8 ч. Некоторые больные годами успешно лечатся медикаментозно, но у мужчин возможности хронической терапии обычно ограничены частым развитием гинекомастии, снижением либидо и появлением импотенции.
При подозрении на двустороннюю гиперплазию хирургическое вмешательство показано только в тех случаях, когда выраженную и сопровождающуюся клиническими симптомами гипокалиемию не удается купировать медикаментозно с помощью, например, спиронолактона, триамтерена или амилорида. Двусторонняя адреналэктомия, как правило, не улучшает течения гипертензии, связанной с идиопатической гиперплазией.
Вторичный альдостеронизм. Вторичным альдостеронизмом называют со
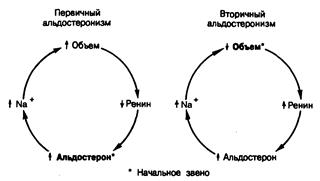
Рис. 325-10. Реакции регуляторной петли ренин—альдостерон на изменение объема при первичном и вторичном альдостеронизме.
ответствующее повышение продукции альдостерона в ответ на активацию ренин-ангиотензиновой системы (рис. 325-10). Скорость продукции альдостерона у больных с вторичным альдостеронизмом часто выше, чем при первичном альдостеронизме. Вторичный альдостеронизм сочетается обычно с быстрым развитием гипертензии или возникает вследствие отечных состояний. При беременности вторичный альдостеронизм представляет собой нормальную физиологическую реакцию на вызываемое эстрогенами увеличение уровня субстрата ренина в крови и активности ренина плазмы, а также на антиальдостероновый эффект прогестинов.
При гипертензивных состояниях вторичный альдостеронизм развивается либо вследствие первичной гиперпродукции ренина (первичный ренинизм), либо на почве такой его гиперпродукции, которая в свою очередь обусловлена уменьшением почечного кровотока и/или почечного перфузионного давления (см. рис. 325-5). Вторичная гиперсекреция ренина может быть следствием сужения одной или обеих главных почечных артерий, вызванного атеросклеротической бляшкой или фиброзно-мышечной гиперплазией. Гиперпродукция ренина обеими почками возникает также при тяжелом артериолярном нефросклерозе (злокачественная гипертензия) или вследствие сужения глубоких почечных сосудов (фаза ускорения гипертензии). Вторичный альдостеронизм характеризуется гипокалиемическим алкалозом, умеренным или выраженным повышением активности ренина плазмы и умеренным или выраженным повышением уровня альдостерона (см. гл. 196).
Вторичный альдостеронизм с гипертензией может возникать также при редких ренинпродуцирующих опухолях (так называемый первичный ренинизм). У таких больных имеются биохимические признаки вазоренальной гипертензии, однако первичное нарушение заключается в секреции ренина опухолью, исходящей из юкстагломерулярных клеток. Диагноз устанавливают на основании отсутствия изменений в почечных сосудах и/или при рентгенологическом выявлении объемного процесса в почке и одностороннего повышения активности ренина в крови из почечной вены.
Вторичный альдостеронизм сопровождает многие виды отеков. Повышение скорости секреции альдостерона имеет место у больных с отеками на почве цирроза печени или нефротического синдрома. При застойной сердечной недостаточности степень повышения секреции альдостерона зависит от тяжести декомпенсации кровообращения. Стимулом к секреции альдостерона в этих условиях служит, по-видимому, артериальная гиповолемия и/или снижение артериального давления. Прием диуретиков часто усиливает вторичный альдостеронизм за счет уменьшения объема; в таких случаях на первый план выступают гипокалиемия и иногда алкалоз.
Вторичный гиперальдостеронизм изредка встречается и в отсутствие отеков или гипертензии (синдром Бартера). Этот синдром характеризуется признаками тяжелого гиперальдостеронизма (гипокалиемический алкалоз) с умеренным или выраженным повышением активности ренина, но нормальным артериальным давлением и отсутствием отеков. При биопсии почек обнаруживают гиперплазию юкстагломерулярного комплекса. Патогенетическую роль может играть нарушение способности почек задерживать натрий или хлорид. Считают, что потеря натрия через почки стимулирует секрецию ренина и затем продукцию альдостерона. Гиперальдостеронизм вызывает потерю калия, а гипокалиемия еще больше повышает активность ренина плазмы. В ряде случаев гипокалиемия может потенцироваться нарушением почечной задержки калия. Один из сопутствующих дефектов заключается в повышенной продукции простагландинов (см. гл. 228).
Синдромы избытка надпочечниковых андрогенов. Синдромы, обусловленные избытком надпочечниковых андрогенов, связаны с чрезмерной продукцией дегидроэпиандростерона и андростендиона, которые вне надпочечников превращаются в тестостерон. Повышенный уровень последнего и определяет большинство андрогенных эффектов. Избыточная продукция андрогенов надпочечников может сопровождаться секрецией большего или меньшего количества других надпочечниковых гормонов и поэтому проявляться не только «чистыми» синдромами вирилизации, но и «смешанными» синдромами, характеризующимися чрезмерной продукцией глюкокортикоидов и некоторыми чертами синдрома Кушинга. ^
Клинические признаки и симптомы. Признаки и симптомы избытка андрогенов можно разделить на четыре группы: гирсутизм, олигоменорея, акне и вирилизация. С клинической точки зрения важно отличать простой гирсутизм от гирсутизма с вирилизацией. В большинстве случаев простого гирсутизма причина усиленного роста волос остается неизвестной. С другой стороны, при наличии у больных не только гирсутизма, но и вирилизации обычно имеет место повышение уровня андрогенов. Под гирсутизмом понимают, как правило, избыточный рост волос при мужском типе их распределения у женщин (см. гл. 46). Он может сопровождать синдромы избытка андрогенов яичникового или надпочечникового происхождения, возникать от приема некоторых препаратов, а также быть семейным или идиопатическим. В отсутствие других признаков повышения продукции андрогенов последнее, вероятно, редко служит причиной гирсутизма.
Четыре компонента вирилизации включают облысение висков, изменение внешнего вида от женского к мужскому (например, потеря тазовых отложений жира и увеличение мускулистости верхней половины тела), увеличение клитора и снижение тембра голоса. Степень вирилизации отражает обычно длительность и выраженность избыточной секреции андрогенов, хотя бывают случаи значительной вирилизации при минимальных изменениях продукции тестостерона и значительного повышения его продукции при минимальных признаках вирилизации. Наличие олигоменореи у женщины с гирсутизмом увеличивает вероятность обнаружения избыточной секреции андрогенов. Поэтому обследование женщин с гирсутизмом должно включать тщательный учет анамнестических данных о начале менархе, прошлых и настоящих менструальных циклах и беременностях, а также тщательный поиск признаков и симптомов избытка андрогенов.
Этиология. Как и другие состояния гипер4)ункции коры надпочечников, синдромы, связанные с избытком андрогенов, могут развиваться на почве гиперплазии, аденомы или рака (две последние причины рассматривались выше). Гиперпродукция надпочечниковых андрогенов может быть и результатом врожденной гиперплазии надпочечников, обусловленной ферментативными дефектами. У таких больных повышенная продукция андрогенов надпочечниками сопровождается либо возрастанием, либо снижением секреции минералокортикоидов или снижением продукции глюкокортикоидов. Так как у человека главным надпочечниковым стероидом, регулирующим секрецию АКТГ, является кортизол и так как АКТГ стимулирует продукцию как кортизола, так и надпочечниковых андрогенов, ферментные нарушения на пути синтеза кортизола могут приводить к повышению секреции надпочечниковых андрогенов. При тяжелой врожденной вирилизирующей гиперплазии надпочечников секреция кортизола надпочечниками может быть нарушена в такой степени, что это сопровождается глюкокортикоидной недостаточностью, несмотря па анатомическую гиперплазию надпочечников.
Врожденная гиперплазия надпочечников представляет собой наиболее частую форму патологии этих желез у младенцев и детей. У таких детей обычно имеются тяжелые фермептные дефициты (см. гл. 333). Недостаточность ферментов обусловливается аутосомно-рецессивными мутациями. Частичная недостаточность надпочечниковых ферментов, особенно у женщин с гирсутизмом и олигоменореей, по минимальной вирилизацией, может проявляться после полового созревания. Позднее начало гиперплазии надпочечников определяет появление патологии почти у 25% женщин с гирсутизмом и олигоменореей.
Врожденная гиперплазия надпочечников обусловливается одним из нескольких нарушений синтеза стероидов. На сегодняшний день описаны дефекты С-21, С-18, С-17 и С-11-гидроксилаз, а также 3b-ол-дегидрогеназы (см. рис. 325-2). Эти ферментные дефициты обычно встречаются порознь. Недостаточность С-21-гидроксилазы сопряжена с экспрессией определенных антигенов гистосовместимости на лейкоцитах (HLA-B локус 6-й хромосомы), так что HLA-типирование можно использовать для выявления гетерозиготных носителей среди членов пораженных семей (см. гл. 63). Клинические проявления при различных нарушениях варьируют от вирилизации у женщин (недостаточность С-21-гидроксилазы) до феминизации у мужчин (недостаточность 3b-ол-дегидрогеназы) (см. также гл. 333).
Надпочечниковая вирилизация у новорожденных девочек проявляется нечеткостью дифференцировки наружных гениталий (женский псевдогермафродитизм). Вирилизация чаще всего начинается после 5-го месяца внутриутробной жизни. У мальчиков при рождении может отмечаться макрогенитосомия, а у девочек —увеличение клитора, частичное или полное сращение половых губ и иногда урогенитальный синус. Если половые губы срастаются почти полностью, гениталии девочек напоминают пенис с гипоспадией.
В постнатальном периоде врожденная гиперплазия надпочечников сопровождается вирилизацией у девочек и изосексуальным преждевременным половым развитием у мальчиков. Избыток андрогенов приводит к ускорению роста, причем костный возраст превышает хронологический. Поскольку избыток андрогенов ускоряет закрытие эпифизарных щелей, рост прекращается, но развитие туловища продолжается, что придает больным характерный вид: они низкорослы, с хорошо развитым туловищем.
Наиболее частая форма врожденной гиперплазии надпочечников (95% всех больных) обусловливается нарушением С-21-гидроксилирования. Помимо недостаточности кортизола, примерно у 30% больных снижена секреция альдостерона. Таким образом, при недостаточности С-21-гидроксилазы надпочечниковая вирилизация не обязательно сопровождается тенденцией к потере соли, связанной с дефицитом альдостерона (см. рис 325-2).
При недостаточности С-11-гидроксилазы развивается «гипертонический» вариант врожденной гиперплазии надпочечников. Повышение артериального давления и гипокалиемия обусловливаются нарушением превращения 11-дезоксикортикостерона в кортикостерон, что приводит к накоплению 11-дезоксикортикостерона— мощного минералокортикоида. При этом опять-таки биосинтез стероидов шунтируется на андрогенный путь.
Недостаточность С -17-гидроксилазы характеризуется гипогонадизмом, гипокалиемией и гипертензией. Это редко встречающееся нарушение обусловливает снижение продукции кортизола с направлением предшественников на минералокортикоидный путь, что приводит к гипокалиемическому алкалозу, повышению артериального давления и снижению активности ренина плазмы. Продукция 11 -дезоксикортикостерона повышена. Так как С-17-гидроксилирование является необходимым этапом биосинтеза надпочечниковых андрогенов, равно как и образующихся в половых железах тестостерона и эстрогенов, этот дефект сопровождается отсутствием полового созревания, высоким уровнем гонадотропинов в моче и низкой экскрецией с мочой 17-кетостероидов. У женщин возникает первичная аменорея и не развиваются вторичные половые признаки. У мужчин из-за сниженной продукции андрогенов выявляют либо нечетко дифференцированные наружные гениталии, либо женский фенотип (мужской псевдогермафродитизм). Гипертензивный синдром можно снять экзогенными глюкокортикоидами, а половое созревание стимулировать соответствующими половыми стероидами.
При недостаточности 3b-ол-дегидрогеназы нарушается превращение прегненолона в прогестерон, в результате чего блокируются пути биосинтеза как кортизола, так и альдостерона, а биосинтез андрогенов в надпочечниках усиливается за счет превращения 17a-гидроксипрегненолона в дегидроэпиандростерон. Поскольку дегидроэпиандростерон — слабый андроген, а недостаточность этого фермента проявляется и в половых железах, гениталии мужского плода могут быть не полностью вирилизованы или даже феминизированы. И наоборот, у девочек гиперпродукция дегидроэпиандростерона может вызвать частичную вирилизацию.
Диагностика. Диагноз врожденной гиперплазии надпочечников следует предполагать у всех плохо развивающихся детей, особенно при наличии приступов острой недостаточности надпочечников, потери соли или постоянной гипертензии. Гипертрофия клитора, сращение половых губ или наличие урогенитального синуса у девочек и изосексуальное преждевременное половое развитие у мальчиков служат подтверждением диагноза. У младенцев и детей с блокадой С-21-гидроксидирования повышение экскреции 17-кетостероидов с мочой и уровня ДГЭА-сульфата в плазме, как правило, сочетается с повышением содержания в крови 17(х-гидроксипрогестерона и экскреции с мочой метаболита этого стероида— прегнантриола.
Диагноз врожденной гиперплазии надпочечников с потерей соли, обусловленной дефектом С-21 -гидроксилазы, подозревают на основании приступов острой надпочечниковой недостаточности с гипонатриемией, гиперкалиемией, обезвоживанием и рвотой. Такие младенцы и дети часто просят соль, при лабораторных исследованиях у них обнаруживают дефицит секреции и кортизола, и альдостерона.
При гипертензивной форме врожденной гиперплазии надпочечников на почве нарушения С-11-гидроксилирования накапливаются 11-дезоксикортикостерон и 11-дезоксикортизол. Экскреция с мочой как 17-кетостероидов, так и 17-гидроксикортикостероидов может быть повышена, так как по методике Силбера—Портера 11-дезоксикортизол входит в число определяемых хромогенов. Подтверждением диагноза служит повышенный уровень 11-дезоксикортизола в крови или повышенных количеств тетрагидро-11-дезоксикортизола в моче.
Очень высокие уровни дегидроэпиандростерона в моче при низком содержании в ней прегнантриола и метаболитов кортизола характерны для больных с недостаточностью 3b-ол-дегидрогеназы. При этом может иметь место и выраженная потеря соли.
У больных с поздним началом гиперплазии надпочечников (частичная недостаточность С-21-гидроксилазы) отмечаются нормальные или умеренно повышенные уровни 17-кетостероидов в моче и ДГЭА-сульфата в плазме. Подтверждением диагноза частичной недостаточности гидроксилазы служит высокое базальное содержание предшественников биосинтеза кортизола (например, 17-гидроксипрогестерона) или их повышение после стимуляции АКТГ. Неясно, сколь долго нужно вводить АКТГ, чтобы демаскировать недостаточность ферментов. Секреция надпочечниковых андрогенов легко подавляется в ходе стандартного малого теста о дексаметазоном (2 мг).
Диффереициальная диагностика. Гирсутизм, исходя из его причин, можно разделить на четыре большие группы: семейный, идиопатический, обусловленный избытком андрогенов и связанный с приемом некоторых препаратов. Первые два состояния, как правило, не сопровождаются другими признаками избыточной секреции андрогенов, например олигоменореей, выраженными акне или вирилизацией. Подобно этому, и гирсутизм, вызываемый экзогенными препаратами, не сопровождается обычно признаками и симптомами избытка андрогенов, если только используемое вещество — не андроген. К веществам, усиливающим оволосение тела, относятся фенотиазины, миноксидил и фенитоин. Каждое из них, особенно миноксидил, вызывает генерализованное усиление роста волос, и не только в андрогензависимых участках тела. Механизм этого эффекта может заключаться в новообразовании волосяных фолликулов.
Если прием таких веществ исключен, то единственной причиной гирсутизма, на которую можно направить лечение, остается избыточная продукция андрогенов надпочечниками или яичниками.
У женщин требует дифференциации надпочечниковый и яичниковый генез гирсутизма и вирилизации (табл. 325-7). Острое начало прогрессирующего гирсутизма и вирилизации позволяет предполагать опухоль надпочечников или яичников. Аденомы и раки надпочечников могут являться причиной чистого или смешанного вирильного синдрома. Так как надпочечниковые андрогены гораздо слабее тех, которые вырабатываются в половых железах, вирилизм надпочечникового генеза характеризуется резким повышением экскреции 17-кетостероидов с мочой. Вирилизующие аденомы надпочечников встречаются редко. Для ви-
Таблица 325-7. Причины гирсутизма у женщин
I. Семейный
II. Идиопатический
III. Патология яичников
Синдром поликистозных яичников; гиперплазия хилусных клеток Опухоли: арренобластома, хилусноклеточная, из остатков надпочечниковой ткани
IV. Патология надпочечников
Врожденная гиперплазия надпочечников
Приобретенная гиперплазия надпочечников (синдром Кушинга)
Опухоли: вирилизующий рак или аденома рилизующих раков надпочечников — наиболее частых надпочечниковых опухолей, вызывающих вирилизацию, характерны высокие уровни ДГЭА-сульфата в плазме и высокая экскреция 17-кетостероидов с мочой; содержание кортизола и экскреция 17-гидроксикортикостероидов в пределах нормы или умеренно повышены. Отдифференцировать вирилизующие аденомы надпочечников от рака в клинике с помощью КТ-сканирования можно еще до операции, так как размеры раковых опухолей, как правило, превышают 6 см. Отсутствие снижения уровней 17-кетостероидов в моче и ДГЭА-сульфата в плазме до нормы после приема дексаметазона (0,5 мг внутрь каждые 6 ч в течение 2 дней) подтверждает диагноз вирилизующей опухоли надпочечников и позволяет исключить врожденную гиперплазию этих желез. Наиболее частой вирилизующей опухолью яичников является арренобластома, но и другие яичниковые опухоли, такие как опухоль из остатков надпочечниковой ткани, гранулезоклеточная опухоль, хилусноклеточная опухоль и опухоль Бреннера, могут сопровождаться вирилизацией. Вирильность, обусловленная опухолями яичников, обычно характеризуется нормальным уровнем 17-кетостероидов в моче и ДГЭА-сульфата в плазме, так как опухоль секретирует, как правило, сильный андроген — тестостерон. У некоторых больных с опухолями яичников экскреция 17-кетостероидов иногда несколько повышается, но, за исключением опухолей из остатков надпочечниковой ткани, фоновая экскреция этих веществ более 30 мг в сутки встречается редко. Как и при опухолях надпочечников, функция яичниковых опухолей не подавляется дексаметазоном. За исключением опухолей из остатков надпочечниковой ткани, они, как правило, не реагируют и на стимуляцию АКТГ. Сам по себе факт повышения уровня тестостерона в плазме или его экскреции с мочой еще не позволяет говорить о расположении опухоли именно в яичниках, так как уровень тестостерона может возрастать и вследствие периферического его образования из надпочечниковых предшественников, таких как ДГЭА (см. гл.331).
Наиболее распространенной причиной избыточной продукции андрогенов яичниками служит гиперплазия яичников или синдром поликистозных яичников (см. гл. 331). В отличие от опухолей яичников или надпочечников вирилизация при поликистозе яичников встречается реже, а гирсутизм — очень часто. В большинстве случаев экскреция 17-кетостероидов превышает норму. Хотя дексаметазон несколько снижает скорость экскреции, тем не менее она превышает таковую у здоровых людей. Уровни в плазме и скорости продукции андростендиена и в меньшей степени тестостерона обычно повышены. Содержание фолликулостимулирующего гормона (ФСГ) несколько ниже нормы, а уровень лютеинизирующего гормона (ЛГ) постоянно повышен, что обусловливает характерный рост отношения ЛГ/ФСГ. Результаты крови и мочи больных с гирсутовирильными синдромами суммированы в табл. 325-8.
Таблица 325-8. Лабораторные показатели при гирсутовирильных синдромах
Дата добавления: 2015-07-25; просмотров: 100 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Лабораторная оценка функции коры надпочечников | | | Гипофункция коры надпочечников |