
Основным андрогеном, секретируемым надпочечниками, является дегидроэпиандростерон (ДГЭА) и его С-3-эфир с серной кислотой. За сутки секретируется 15—30 мг этих соединений. В небольших количествах секретируются также 11b-андростендион, 11b-гидроксиандростендион и тестостерон. ДГЭА служит главным предшественником 17-кетостероидов мочи. Две трети их количества, выявляемого в моче мужчин, образуется при метаболизме надпочечниковых стероидов, а оставшаяся треть — из андрогенов семенников. У женщин 17-кетостероиды мочи почти полностью имеют надпочечниковое происхождение.
Физиология АКТГ. Кортикотропин (АКТГ, см. гл. 321) представляет собой неразветвленный полипептид, содержащий 39 аминокислот. АКТГ и ряд других пептидов (липотропины, эндорфины и меланоцитстимулирующие гормоны) образуются из более крупной молекулы предшественника проопиомеланокортина (ПОМ К, см. гл. 69 и 321, а также рис. 325-3) с мол. массой 31 000. АКТГ синтезируется и накапливается в клетках передней доли гипофиза. Базофильное окрашивание кортикотрофов — это результат гликозилирования АКТГ и родственных ему пептидов. Основной потенциал кортикотропного действия АКТГ сосредоточен в меньших полипептидных фрагментах: N-концевая структура из 18 аминокислот сохраняет всю биологическую активность, а еще более короткие N-концевые фрагменты обладают частичной биологической активностью АКТГ. Секреция АКТГ и родственных пептидов передней долей гипофиза контролируется «кортикотропин-рилизинг-центром», расположенным в срединном возвышении гипоталамуса, при стимуляции которого выделяется пептид, содержащий 41 аминокислоту (кортикотропин-рилизинг-гормон, КРГ); этот пептид поступает через портальный кровоток ножки гипофиза в его переднюю долю, где вызывает секрецию АКТГ (рис. 325-4). В эквимолярных концентрациях с АКТГ секретируется и ряд родственных ему пептидов, таких как b-липотропин (b-ЛПГ), что свидетельствует об их ферментативном отщеплении от предшественника (ПОМК) до начала или

Рис. 325-3. Схематическое изображение вероятной структуры молекулы проопиомеланокортинасмол.массой 31 000. (По D. Т. Krieger,J. В. Martin, N. Engl.J. Med., 304:880, 1981. С разрешения New England Journal of Medicine.)

Рис. 325-4. Ось гипоталамус—гипофиз—надпочечники.
Основные пункты замыкания обратной связи в механизме регуляции уровня кортизола в плазме расположены в гипофизе (1) и в гипоталамическом кортикотропин-рилизинг центре (2). Эта связь может замыкаться в высших нервных центрах (3) и/или в самих надпочечниках (4). Возможно также существование короткой петли ингибирования КРГ со стороны АКТГ; a-адренергические агонисты и гаммааминомасляная кислота (ГАМК), по-видимому, тормозят выделение КРГ. Опиоидные пептиды — b-эндорфин и энкефалин тормозят, а вазопрессин и ангиотензин II усиливают секрецию КРГ и АКТГ КРГ— кортикотропин-рилизинг гормон; b-ЛПГ— b-липотропин; ПОМК — проопиомеланокортин
в ходе секреторного процесса. Однако уровни b-эндорфина при определенных стимулах могут меняться независимо от уровней АКТГ в крови. Функция и регуляция секреции родственных АКТГ пептидов, образующихся из ПОМК, остаются неясными.
К основным факторам, контролирующим секрецию АКТГ, относятся КРГ, концентрация свободного кортизола в плазме, стресс и цикл сон—бодрствование (рис. см. 325-4). В течение дня уровень АКТГ в плазме меняется вследствие его импульсной секреции, но в целом существует суточная периодичность с максимумом тотчас перед пробуждением и минимумом незадолго до отхода ко сну. При изменении цикла сон—бодрствование характер секреции АКТГ уже через несколько дней приобретает соответствие новому циклу. Уровни АКТГ и кортизола возрастают также после еды. Стресс (например, введение пирогенов, хирургическая операция, гипогликемия, физическая нагрузка и тяжелые эмоциональные переживания) в свою очередь повышает секрецию АКТГ. Связанная со стрессом секреция АКТГ нарушает суточную периодичность продуцирования гормона, но и сама снимается предварительным введением больших доз глюкокортикоидов. Секреция АКТГ при стрессе и нормальная импульсная и ритмическая его секреция регулируются КРГ; это так называемая открытая петля механизма обратной связи. На секрецию КРГ в свою очередь влияют гипоталамические нейротрансмиттеры. Например, серотонинергическая и холинергическая системы стимулируют секрецию КРГ и АКТГ; относительно игибиторных влияний a-адренергических агонистов и гамма-аминомасляной кислоты (ГАМК) на секрецию КРГ данные противоречивы. Кроме того, может иметь место и непосредственное действие этих нейротрансмиттеров на гипофиз. Имеются также данные о пептидергической регуляции секреции АКТГ. Например, бета-эндорфин и энкефалин тормозят, а вазопрессин и ангиотензин II усиливают секрецию АКТГ. Наконец, секрецию АКТГ регулирует уровень свободного кортизола в плазме. Кортизол снижает чувствительность кортикотрофов гипофиза к КРГ, т. е. в присутствии кортизола нужно большее количество КРГ, чтобы вызвать данный прирост секреции АКТГ. Глюкокортикоиды ингибируют и секрецию КРГ. Этот сервомеханизм демонстрирует ведущую роль концентрации кортизола в крови в регуляции секреции АКТГ. Ингибирование продукции АКТГ протекает в две фазы: 1) ранняя быстрая отрицательная обратная связь опосредуется, вероятно, мембранным эффектом, сохраняется меньше 10 мин и зависит от скорости повышения уровня глюкокортикоидов; и 2) зависимая от времени поздняя реакция по механизму обратной связи обусловливается, по-видимому, торможением синтеза белка-предшественника. Торможение секреции АКТГ, приводящее к атрофии надпочечников при длительной терапии глюкокортикоидами, может быть связано в основном с подавлением секреции КРГ на уровне гипоталамуса, поскольку в таких условиях экзогенное введение КРГ продолжает вызывать подъем уровня АКТГ в плазме. Кортизол влияет по механизму обратной связи и на вышележащие центры головного мозга (гиппокамп, ретикулярную систему и перегородку), а также, вероятно, на саму кору надпочечников (см. рис. 325-4).
Биологический период полужизни АКТГ в крови не достигает и 10 мин. Действие АКТГ также проявляется быстро; концентрация стероидов в венозной крови надпочечников возрастает уже через несколько минут после его поступления в кровь. АКТГ стимулирует стероидогенез путем активации связанной с мембраной аденилатциклазы. Аденозин-3, 5'-монофосфат (циклический АМФ) в свою очередь активирует ферменты протеинкиназы, приводя тем самым к фосфорилированию белков, активирующих биосинтез стероидов (см. гл. 67).
Физиология системы ренин—ангиотензин (см. также гл. 196). Ренин представляет собой протеолитический фермент, вырабатываемый и запасаемый в гранулах юкстагломерулярных клеток, которые окружают а4)ферентные артериолы почечных клубочков. Ренин существует в активной и неактивной формах. Неясно, является ли неактивная форма предшественником («проренином») или она образуется в качестве продукта уже после высвобождения ренина. Юкстагломерулярный аппарат включает как юкстагломерулярные клетки, так и клетки плотного пятна. Ренин действует на основной субстрат ангиотензиноген (присутствующий в крови a2-глобулин, продуцируемый печенью), образуя из него декапептид ангиотензин I (рис. 325-5). Затем ангиотензин I под влиянием превращающего фермента трансформируется в октапептид ангиотензин II путем отщепления двух С-концевых аминокислот. Ангиотензин II—это наиболее активное прессорное соединение (в расчете на мол. массу) из вырабатываемых в организме, и свое прессорное действие он оказывает, влияя непосредственно на гладкие мышечные клетки артериол. Кроме того, ангиотензин II служит мощным стимулятором продукции альдостерона клубочковой зоной коры надпочечников; нонапептид ангиотензин III также может стимулировать продукцию альдостерона. Ангиотензин II быстро разрушается ангиотензиназами (период его полужизни около 1 мин), тогда как период полужизни ренина более продолжителен (10—
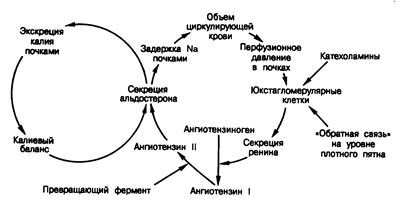
Рис. 325-5. Взаимосвязь объемной и калиевой петель обратной связи в их действии на секрецию альдостерона.
Уровень секреции альдостерона определяется интеграцией сигналов из каждой петли.
20 мин). Ткани других органов, таких как матка, сосуды, мозг и слюнные железы, также вырабатывают рениноподобные соединения. Значение этих так называемых изоренинов неизвестно.
Секреция ренина контролируется четырьмя независимыми факторами, и количество выделяющегося ренина — это результативное действие всех их. Юкстагломерулярные клетки, представляющие собой специализированные миоэпителиальные клетки, расположенные в средней оболочке стенки, приносящей артериолы, выступают в роли миниатюрных датчиков, воспринимающих почечное перфузионное давление и соответствующие изменения перфузионного давления в приносящих артериолах. Например, в условиях снижения объема циркулирующей крови происходит соответствующее снижение перфузионного давления в почках и, как следствие, давления в приносящих артериолах (см. рис. 325-5). Юкстагломерулярные клетки воспринимают это как уменьшение силы растяжения стенок приносящих артериол. В ответ эти клетки выделяют в почечный кровоток большие количества ренина, что приводит к образованию ангиотензина I, который в почках и периферических тканях превращается в ангиотензин II под действием пептидилпептидгидролазы (так называемого превращающего фермента). Ангиотензин II стимулирует кору надпочечников к секреции альдостерона. Повышенный уровень альдостерона в плазме крови приводит к увеличению задержки натрия в почках и тем самым обусловливает повышение объема внеклеточной жидкости. Это в свою очередь снимает первоначальный сигнал к высвобождению ренина. В данном контексте система ренин—ангиотензин—альдостерон обеспечивает регуляцию объема жидкости путем адекватного изменения транспорта натрия в почечных канальцах.
Второй механизм регуляции секреции ренина сосредоточен в клетках плотного пятна — группе эпителиальных клеток дистальных извитых канальцев, расположенных напротив юкстагломерулярных клеток. Они способны выполнять функцию хеморецепторов, следящих за уровнем натрия (или хлорида) в дистальных канальцах и передающих эту информацию юкстагломерулярным клеткам, где и происходит нужная модификация секреции ренина. В условиях поступления к плотному пятну повышенного количества фильтруемого натрия обратная связь в юкстагломерулярном комплексе замыкается, что приводит к высвобождению больших количеств ренина, способных уменьшить скорость клубочковой фильтрации и тем самым снизить фильтруемое количество натрия.
Симпатическая нервная система регулирует высвобождение ренина в ответ на переход тела в вертикальное положение. Механизм эффекта заключается либо в непосредственной активации аденилатциклазы в юкстагломерулярных клетках, либо в опосредованном действии на эти клетки или клетки плотного пятна через сужение приносящих артериол.
Наконец, на высвобождение ренина могут влиять и факторы, содержащиеся в крови. Увеличение калия в диете прямо снижает секрецию ренина; уменьшение потребления калия повышает секрецию ренина. Значение этих эффектов калия остается неясным. Сам по себе ангиотензин II может по механизму обратной связи тормозить секрецию ренина независимо от изменений почечного кровотока, давления или секреции альдостерона. Высвобождение ренина могут ингибировать и предсердные натрийуретические пептиды. Таким образом, в сложной регуляции секреции ренина принимают участие как внутрипочечные (рецепторы давления и плотное пятно), так и внепочечные (симпатическая нервная система, калий, ангиотензин и т. д.) механизмы. Данный уровень секреции ренина отражает, вероятно, действие всех этих факторов, но преобладающее значение имеют внутрипочечные механизмы.
Физиология глюкокортикоидов. Деление надпочечниковых стероидов на глюкокортикоиды и минералокортикоиды достаточно произвольно, поскольку большинство глюкокортикоидов обладает некоторыми свойствами минералокортикоидов и наоборот. Описательный термин глюкокортикоиды применяют к тем стероидам надпочечников, которые преимущественно влияют на интермедиарный обмен. Главным глюкокортикоидом является кортизол (гидрокортизон). Кортизол проникает в клетки-мишени путем диффузии, образует комплекс со специфическими цитоплазматическими рецепторными белками, которые обладают высоким сродством к гормону, и переносится к специфическим акцепторным участкам хроматина ядра, где после этого увеличивается синтез РНК, а позднее и синтез белка. Таким образом, другим способом определения понятия «глюкокортикоидный эффект» является его опосредование данным классом цитоплазматических рецепторов, обладающих высоким сродством к гормону (глюкокортикоидные рецепторы) (см. гл. 320). Физиологическое действие глюкокортикоидов на межуточный обмен включает регуляцию метаболизма белков, углеводов, липидов и нуклеиновых кислот. Эти эффекты имеют в основном катаболическую направленность и характеризуются ускорением распада белка и повышением экскреции азота. Глюкокортикоиды увеличивают содержание гликогена в печени и способствуют печеночному синтезу глюкозы (гликонеогенез). Такое действие объясняется главным образом мобилизацией гликогенных аминокислотных предшественников из периферических опорных структур, таких как кости, кожа, мышцы и соединительная ткань, вследствие усиления распада белка, а также торможения его синтеза и поглощения аминокислот этими тканями. Вызываемая глюкокортикоидами гипераминоацидемия способствует гликонеогенезу и за счет стимуляции секреции глюкагона. Глюкокортикоиды непосредственно действуют на печень, стимулируя синтез некоторых ферментов, таких как тирозинаминотрансфераза и триптофанпирролаза. В большинстве тканей кортикоиды ингибируют синтез нуклеиновых кислот, но в печени синтез рибонуклеиновой кислоты (РНК) возрастает. Глюкокортикоиды регулируют мобилизацию жирных кислот, повышая активирующее действие жиромобилизующих гормонов (например, катехоламинов и гипофизарных пептидов) на клеточную липазу.
Кортизол по-разному влияет на структурный белок и жировую ткань разных частей тела. Например, фармакологические дозы кортизола уменьшают содержание белкового матрикса в позвонках (трабекулярная кость), но лишь в минимальной степени действуют на длинные кости (имеющие преимущественно плотное строение); периферические жировые депо могут истощаться, тогда как в области живота и между лопаток жир накапливается.
Уровень кортизола меняется уже через несколько минут после разнообразных физических (травма, хирургическая операция, физическая нагрузка) и психических (тревога, депрессия) стрессов. Мощными стимулами секреции АКТГ и кортизола служат также гипогликемия и лихорадка. Почему повышенные уровни глюкокортикоидов защищают организм от стресса, неясно, но в их отсутствие такие стрессы могут вызывать падение давления, шок и смерть. Поэтому лицам с гипофункцией гипофизарно-надпочечниковой системы в условиях стресса всегда следует увеличивать дозы вводимых глюкокортикоидов.
Глюкокортикоиды обладают противовоспалительными свойствами, которые связаны, по-видимому, с влиянием этих гормонов как на микрососуды, так и на клетки. Кортизол обеспечивает сохранение реактивности сосудов по отношению к содержащимся в крови вазоконстрикторным факторам и противодействуют повышению проницаемости капилляров, характерному для острого воспаления. Глюкокортикоиды увеличивают содержание в крови полиморфно-ядерных лейкоцитов; масса циркулирующих лейкоцитов возрастает как за счет ускорения выхода зрелых клеток из костного мозга, так и за счет торможения их просачивания через стенки капилляров. Кортизол угнетает и продукцию интерлейкина-2 макрофагами. Меньшее прилипание макрофагов к эндотелию сосудов после введения глюкокортикоидов связано, вероятно, с антагонистическим действием последних по отношению к фактору ингибирования миграции (МИФ). Глюкокортикоиды уменьшают содержание эозинофилов в крови и массу лимфоидной ткани в организме, особенно
Т-клеток или малых лимфоцитов тимуса. Механизм этого эффекта заключается в перераспределении клеток между циркулирующей кровью и другими областями организма. В результате кортизол нарушает клеточное звено иммунитета. По-видимому, только в фармакологических дозах глюкокортикоиды подавляют образование антител и стабилизируют мембраны лизосом, снижая тем самым выход протеолитических кислых гидролаз, локализованных в этих цитоплазматических органеллах. Кортизол оказывает значительное влияние на распределение и экскрецию воды в организме. Он сохраняет объем внеклеточной жидкости, тормозя поступление воды в клетки. На экскрецию воды почками он действует за счет подавления секреции антидиуретического гормона, увеличения скорости клубочковой фильтрации и непосредственного влияния на почечные канальцы; в результате возрастает клиренс свободной воды. Глюкокортикоиды обладают и слабыми минералокортикоидными свойствами: увеличение дозы этих гормонов приводит к повышению реабсорбции натрия в почечных канальцах и экскреции калия с мочой. Глюкокортикоиды могут влиять и на поведенческие реакции. Как при избытке, так и при недостатке кортизола наблюдаются эмоциональные расстройства. Наконец, кортизол подавляет секрецию гипофизарного АКТГ и гипоталамического КРГ.
Физиология минералокортикоидов. Основной минералокортикоид альдостерон обладает двумя важными свойствами. Он является главным регулятором объема внеклеточной жидкости и главным регулятором обмена калия. Эти эффекты опосредуются связыванием альдостерона в тканях-мишенях со специфическими белковыми рецепторами минералокортикоидов. Объем жидкости регулируется за счет прямого действия на транспорт натрия в почечных канальцах. Альдостерон влияет преимущественно на дистальные извитые канальцы, где он вызывает снижение экскреции натрия и увеличивает экскрецию калия. Реабсорбция ионов натрия сопровождается падением трансмембранного потенциала и тем самым усиливает отток положительно заряженных ионов из клетки в просвет канальца. Основной внутриклеточный ион с одиночным положительным зарядом — это калий. Поскольку его концентрация в клетке в 40—80 раз выше, чем в просвете канальца, калий пассивно следует по электрическому градиенту, восстанавливая нормальный положительный заряд содержащейся в просвете канальца жидкости. Реабсорбированные ионы натрия переносятся затем из эпителиальных клеток канальцев в интерстициальную жидкость, а оттуда — в капиллярную кровь почек. Вода пассивно следует за переносимым натрием.
В эпителиальной клетке канальца присутствует и большое количество ионов водорода. Так как их концентрация в просвете канальца выше, чем в клетке, они должны секретироваться активно. Однако сниженный положительный заряд внутри просвета позволяет при той же величине энергетических затрат секретироваться большему количеству водорода. Альдостерон и другие минералокортикоиды действуют также на эпителий протоков слюнных, потовых желез и желудочно-кишечного тракта, всюду вызывая реабсорбцию натрия и «обмен» его на ионы калия.
При введении альдостерона (или дезоксикортикостерона ацетата) здоровому человеку начальный период задержки натрия сменяется натрийурезом, и через 3—5 дней натриевый баланс восстанавливается. Поэтому-то и не развиваются отеки. Данное явление называют «феноменом ускользания», подразумевая «ускользание» почечных канальцев из-под задерживающего натрий действия хронически вводимого альдостерона.
Секреция альдостерона контролируется тремя механизмами: системой ренин—ангиотензин, калием и АКТГ (табл. 325-1). Система ренин—ангиотензин играет главную роль в регуляции объема внеклеточной жидкости за счет изменения секреции альдостерона (см. рис. 325-5). Так, ренин-ангиотензиновая система восстанавливает объем циркулирующей крови, вызывая индуцированную альдостероном задержку натрия при возникновении объемного дефицита и снижая альдостеронзависимую задержку натрия в условиях увеличения объема внеклеточной жидкости.
Ионы калия непосредственно регулируют секрецию альдостерона, действуя независимо от системы ренин—ангиотензин (см. рис. 325-5). Пероральная нагрузка калием у здорового человека увеличивает секрецию и экскрецию альдостерона, а также его уровень в плазме крови. Кроме того, в определенных условиях уровень альдостерона в плазме возрастает при увеличении содержания калия в сыворотке всего на 0,1 мэкв/л.
Физиологические количества АКТГ остро стимулируют секрецию альдостерона, но при инфузии АКТГ более 10— 12 ч этот эффект исчезает. В большинстве исследований признается незначительная роль АКТГ в регуляции синтеза и секреции альдостерона. Например, у лиц, в течение нескольких лет получающих высокие дозы стероидов, что должно было бы полностью подавлять продукцию АКТГ, секреторные реакции альдостерона на ограничение натрия остаются нормальными. Таким образом, хроническая недостаточность АКТГ сама по себе не сказывается на реактивности клеток клубочковой зоны.
Таблица 325-1. Факторы, регулирующие биосинтез альдостерона
| Факторы | Эффекты |
| I. Система ренин—ангиотензин | Стимулирует |
| II. Ионы натрия | Ингибируют (физиологическое значение неясно) |
| III. Ионы калия | Стимулируют |
| IV. Нейротрансмиттеры Дофамин Серотонин | Ингибирует Стимулирует |
| V. Гормоны гипофиза АКТГ Другие гормоны гипофиза (например, гормон роста) | Стимулирует Оказывают пермиссивный эффект (обеспечивают оптимальную реакцию на ограничение натрия) |
| Неидентифицированные гипофизарные факторы Бета-эндорфин g-МСГ | Стимулируют Стимулирует Оказывает пермиссивный эффект |
| VI. Натрийуретические факторы Предсердные факторы Оубаиноподобные факторы | Ингибируют Ингибируют |
После потребления калия или натрия с пищей величина реакции альдостерона на острую стимуляцию меняется. Повышенное потребление калия или сниженное потребление натрия усиливает реакцию клеток клубочковой зоны на острую стимуляцию АКТГ, ангиотензином II и/или калием.
В регуляции секреции альдостерона принимают участие также нейротрансмиттеры (дофамин и серотонин) и некоторые пептиды, такие как предсердный натрийуретический фактор, g-меланоцитстимулирующий гормон (g-МСГ), бета-эндорфин и неидентифицированный гипофизарный фактор, стимулирующий продукцию альдостерона (см. табл. 325-1). Таким образом, в регуляции секреции альдостерона участвуют как стимулирующие, так и ингибирующие факторы.
Физиология андрогенов. Андрогены — это вещества, стимулирующие появление и развитие мужских вторичных половых признаков. Это свое действие они оказывают, связываясь с цитоплазматическими рецепторами, обладающими высоким сродством к соответствующим соединениям. Вторичные половые признаки меняются за счет ингибирования женских (дефеминизация) и усиления мужских признаков (маскулинизация). Клинически это проявляется гирсутизмом и вирилизацией у женщин с аменореей, атрофией грудных желез и матки, увеличением клитора, огрубением голоса, появлением угрей, увеличением мышечной массы и облысением лба (гл. 46).
Стероиды с преимущественно андрогенной активностью содержат 19 углеродных атомов (см. рис. 325-1). Основными надпочечниковыми андрогенами являются дегидроэпиандростерон (ДГЭА), андростендион и 11-гидроксиандростендион. В количественном отношении главные андрогены, секретируемые надпочечниками, — это ДГЭА и его сульфат; ДГЭА и андростендион обладают лишь слабой андрогенной активностью, и свое действие они оказывают, превращаясь вне железы в мощный андроген тестостерон. Секреция надпочечниковых андрогенов стимулируется АКТГ, а не гонадотропинами. При стимуляции АКТГ содержание 17-кетостероидов в моче увеличивается, но в меньшей степени, чем уровень 17-гидроксикортикостероидов. Отсюда следует, что экзогенное введение глюкокортикоидов должно подавлять продукцию надпочечниковых андрогенов.
Дата добавления: 2015-07-25; просмотров: 72 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Биохимия и физиология стероидов | | | Лабораторная оценка функции коры надпочечников |