
Читайте также:
|
Уравнение состояния идеального газа в зависимости от его количества может иметь вид:
 — для 1 кг газа; (1.1)
— для 1 кг газа; (1.1)
 — для m кг газа; (1.2)
— для m кг газа; (1.2)
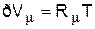 — для 1 кмоля газа, (1.3)
— для 1 кмоля газа, (1.3)
где р – абсолютное давление, Па;
v – удельный объем газа, м3/кг;
V – объем данной массы газа, м3;
V – объем киломоля газа, м3/кмоль;
Т – абсолютная температура, К;
m – масса газа, кг;
– масса киломоля газа, кг/кмоль;
R = 8314 Дж/(кмольЧК) – универсальная газовая постоянная;
 – газовая постоянная, Дж/(кгЧК).
– газовая постоянная, Дж/(кгЧК).
Согласно молекулярно–кинетической теории идеальных газов их удельные мольные и массовые изохорные и изобарные теплоемкости постоянны и рассчитываются по формулам
 , кДж/(кмоль×К); (1.4)
, кДж/(кмоль×К); (1.4)
 , кДж/(кмоль×К); (1.5)
, кДж/(кмоль×К); (1.5)
 ; (1.6)
; (1.6)
 , (1.7)
, (1.7)
где i – число степеней свободы данного газа.
Для одноатомных газов i = 3; для двухатомных газов i = 5; для трех- и многоатомных газов i = 6. Для смеси идеальных газов i не имеет смысла и формулы (1.4) – (1.7) использовать нельзя.
Разность изобарной и изохорной теплоемкостей идеальных газов определяется соотношением Майера:
 ;
;  . (1.8)
. (1.8)
В расчетах политропных процессов используется коэффициент Пуассона, который для однородного газа определяется соотношением
 . (1.9)
. (1.9)
Для смеси идеальных газов i не имеет смысла, и ее в формуле (1.9) применительно к смесям газов использовать нельзя
Дата добавления: 2015-07-25; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Исходные данные и объем задания 1.1 | | | Смесь идеальных газов |