Типы органических реакций
Теоретические аспекты органической химии в схемах | Sp-Гибридизация (линейная) | Механизмы образования ковалентной связи |
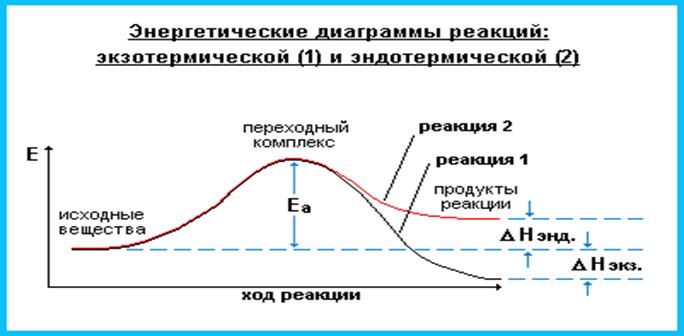
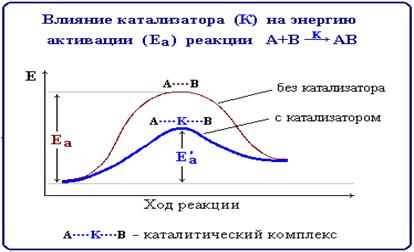
- Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается в продукты реакции уже самопроизвольно.

Изменение энергии в ходе реакции
Энергия активации Еа равна разности энергий переходного и исходного состояний:
Еа = Еперех.сост. - Еисх.сост.
Чем меньше энергия активации реакции, тем выше ее скорость. Эта зависимость выражается уравнением Аррениуса, которое связывает константу скорости реакции k с Еа:

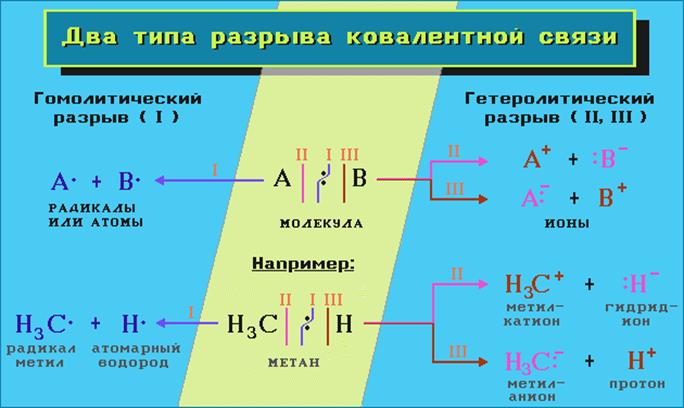
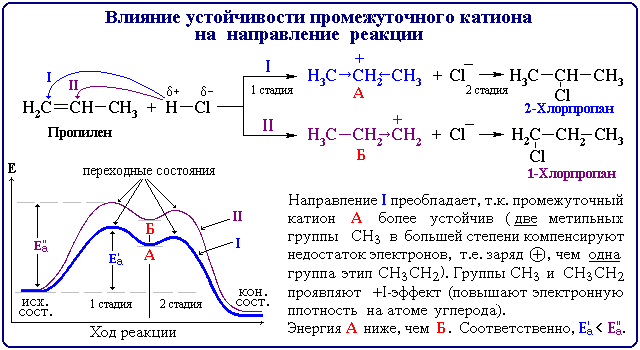
Электронные эффекты - смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей.
Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода.
Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Мезомерный эффект (М -эффект)
- Мезомерный эффект - смещение электронной плотности по цепи делокализованных (сопряженных) p-связей
- Этот эффект проявляют заместители, связанные с sp2- или sp-гибридизованным атомом. Благодаря подвижности p-электронов, М -эффект передается по цепи сопряжения без затухания.
Индуктивный эффект - смещение электронной плотности по цепи s-связей, которое обусловлено различиями в электроотрицательностях атомов.
Из-за слабой поляризуемости s-связей I -эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным 0.
- – I -эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода: -F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.
- + I -эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: -Mg-, -Li; алифатические углеводородные радикалы (-CH3, -C2H5) и т.п.
Дата добавления: 2015-07-11; просмотров: 106 | Нарушение авторских прав
mybiblioteka.su - 2015-2025 год. (0.005 сек.)







