
Читайте также:
|
Физическая адсорбция обусловлена взаимным притяжением молекул сорбтива под действием сил Ван-дер-Ваальса и не сопровождается химическим взаимодействием адсорбированного вещества с поглотителем.
В процессе адсорбции предельным состоянием для каждого поглощаемого вещества является состояние равновесия между концентрацией в адсорбенте а0 и парциальным давлением р адсорбируемого вещества в парогазовой смеси.
Кривая равновесия при постоянной температуре 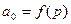 называется изотермой адсорбции и служит основной характеристикой статики процесса.
называется изотермой адсорбции и служит основной характеристикой статики процесса.
Между концентрацией Су адсорбируемого вещества в газовой смеси и его парциальным давлением р, согласно уравнению Клапейрона, существует зависимость:
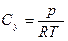 (6.18)
(6.18)
Согласно теории Эйкена и Поляни, располагая изотермой адсорбции пара стандартного вещества для температуры Т1, можно вычислить изотерму адсорбции другого пара при температуре Т2.
Вычисления величин адсорбции производят по формуле:
a2 = a1V1/V2, (6.19)
где а1 и а2 - ординаты изотермы соответственно стандартного вещества (обычно бензола), кг/кг или кмоль/г; V1 и V2 - молярные объемы стандартного и исследуемого вещества, м3.
Молярные объемы определяются по формуле:
V = M/r, (6.20)
где М - молекулярная масса, кг/кмоль; r - плотность жидкости, кг/м3.
Давления вычисляются, исходя из выражения:
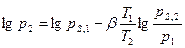 , (6.21)
, (6.21)
где р1 и р2 - парциальные давления стандартного и исследуемого веществ, кПа; pS,1 - давление насыщенного пара стандартного вещества при температуре Т1, кПа; pS,2 - давление насыщенного пара исследуемого вещества при температуре Т2, кПа; b - коэффициент аффинности, равный отношению молярных объемов:
b = V2/V1 (6.22)
Коэффициенты аффинности b для некоторых веществ приведены в таблице 6.3. В качестве стандартного принят бензол.
Таблица 6.3.
| Вещество | b | Вещество | b |
| Метиловый спирт | 0,40 | Уксусная кислота | 0,97 |
| Бромистый метил | 0,57 | Бензол | 1,00 |
| Этиловый спирт | 0,61 | Циклогексан | 1,03 |
| Муравьиная кислота | 0,70 | Четыреххлористый углерод | 1,05 |
| Сероуглерод | 0,76 | Диэтиловый эфир | 1,09 |
| Хлористый этил | 0,78 | Пентан | 1,12 |
| Пропан | 0,86 | Толуол | 1,25 |
| Хлороформ | 0,88 | Хлорпикрин | 1,28 |
| Ацетон | 0,90 | Гексан | 1,35 |
| Бутан | 0,94 | Гептан | 1,59 |
При расчете точек изотермы исследуемого пара координаты а1 и р1 берутся по кривой стандартного вещества, значения р1, р2, pS,1 , pS,2 из таблиц давления насыщенного пара.
Изотерму адсорбции при периодическом процессе можно разделить на три области: первая характеризуется отношением 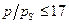 (по бензолу); для второй -
(по бензолу); для второй - 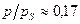 -0,5, а для третьей -
-0,5, а для третьей - 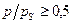 .
.
Для первой области, где изотерма адсорбции считается прямолинейной можно пользоваться формулой:
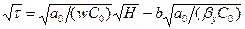 , (6.23)
, (6.23)
где t - продолжительность адсорбции, с; w - скорость парогазового потока, отнесенная к полному сечению аппарата, м/с; Н - высота слоя адсорбента, м; С0 - начальная концентрация адсорбируемого вещества в парогазовом потоке, кг/м3; а0 - количество адсорбированного вещества, равновесное с концентрацией потока С0, кг/м3 (берется по изотерме адсорбции в кг/кг и умножается на насыпную плотность адсорбента в кг/м3); bу - коэффициент массоотдачи, с-1.
Величина коэффициента b берется для значений С/С0 из таблицы 6.4. (где С - содержание адсорбируемого вещества в газовом потоке, выходящем из адсорбера, кг/м3).
Таблица 6.4.
| C/C0 | b | C/C0 | b | C/C0 | b |
| 0,005 | 1,84 | 0,2 | 0,63 | 0,7 | -0,27 |
| 0,01 | 1,67 | 0,3 | 0,42 | 0,8 | -0,46 |
| 0,03 | 1,35 | 0,4 | 0,23 | 0,9 | -0,68 |
| 0,05 | 1,19 | 0,5 | 0,09 | ||
| 0,1 | 0,94 | 0,6 | -0,10 |
Для второй области изотермы адсорбции применяют уравнение:
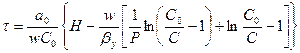 . (6.24)
. (6.24)
Здесь 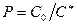 , где С* - содержание вещества в газовом потоке, равновесное с половинным количеством от максимально адсорбируемого данным адсорбентом, кг/м3.
, где С* - содержание вещества в газовом потоке, равновесное с половинным количеством от максимально адсорбируемого данным адсорбентом, кг/м3.
Для третьей области изотермы адсорбции:
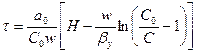 . (6.25)
. (6.25)
Теплота адсорбции складывается из теплоты конденсации и теплоты смачивания. Практически можно принять, что величина теплоты адсорбции органических веществ не зависит от температуры. Зависимость удельной теплоты адсорбции q (Дж/кг адсорбента) от количества поглощенного пара определяется формулой:
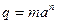 , (6.26)
, (6.26)
где а - количество адсорбированного пара, дм3/кг адсорбента, m, n - константы, значения которых представлены в таблице 6.5.
Таблица 6.5
| Вещество | Формула | n | m×10-3 |
| Бензол | С6Н6 | 0,959 | 3,24 |
| Бромистый этил | С2Н5Вr | 0,900 | 3,77 |
| Диэтиловый эфир | (С2Н5)2О | 0,922 | 3,84 |
| Сероуглерод | СS2 | 0,921 | 3,15 |
| Хлороформ | СНCl | 0,935 | 3,47 |
| Четыреххлористый углерод | CCl4 | 0,930 | 3,74 |
| Этиловый спирт | С2Н5ОН | 0,928 | 3,65 |
При адсорбции водяного пара углем теплота адсорбции зависит от температуры следующим образом:
| Температура, оС................... | |||||
| Теплота адсорбции, q ×10-3, Дж/кмоль. |
Поглощение газов и паров, как правило, производится в динамических условиях – из потока газа-носителя. В этом случае слой сорбента характеризуется величиной динамической адсорбционной активности ад – количеством поглощенного вещества (сорбтива) слоем адсорбента до момента появления за слоем проскока сорбтива:
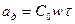 , (6.27)
, (6.27)
где ад - динамическая адсорбционная активность слоя адсорбента, кг/м3; С0 - исходная концентрация сорбтива в газовом потоке, кг/м3; w - скорость парогазовой смеси, отнесенная к полному сечению аппарата, м/с; t - время защитного действия, с.
Дата добавления: 2015-07-11; просмотров: 140 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение | | | Характеристики адсорбентов и их виды |