
Читайте также:
|
кафедра органической химии
Методическое указание к лабораторной работе
«КОРРОЗИЯ»
Астрахань
Основы теории коррозии
Термин коррозия происходит от латинского «corrosio», что означает разъедать, разрушать. Этот термин характеризует как процесс разрушения, так и результат данного разрушения.
Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной средой.
В случае с металлами, говоря об их коррозии, имеют в виду нежелательный процесс взаимодействия металла со средой. Физико-химической сущностью изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным:
1) Подвод коррозионной среды или отдельных ее компонентов к поверхности металла;
2) Взаимодействие среды с металлом;
3) Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Кинетика процессов окисления зависит от природы среды, содержащей окислитель. Если среда представляет собой электролит (очень частый случай), окисление протекает по электрохимическому механизму:
Me  Mez+ + ze (I)
Mez+ + ze (I)
nOx + ze  mRed(2)
mRed(2)
где ox-окислитель, a red- его восстановленная форма.
Реакции (1) и (2) протекают сопряженно на анодных и катодных участках, но подчиняясь каждая своим кинетическим закономерностям. Необходимо только соблюдение условия стационарности процесса, т. е. равенства скоростей окисления металла и восстановления. Из условия стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Если окислитель не является электролитом, то обмен электронами совершается непосредственно между металлом и окислителем:
mMe + nOx 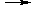 Mem(Red)n
Mem(Red)n
Здесь окисление протекает по химическому механизму.
Классификация коррозионных процессов
1.По механизму процесса различают химическую и электрохимическую коррозию металла.
Химическая коррозия - это взаимодействие металлов с коррозионной средой, при котором окисляется металл и восстанавливаются окислительные компоненты коррозионной среды, протекают в одном акте. Так происходит окисление большинства металлов в газовых средах, содержащих окислитель (например, окисление в воздухе при повышении температуры)
2Mg+ О 2  2MgO
2MgO
4Al + 3O2  2Al2O3
2Al2O3
Электрохимическая коррозия - это взаимодействие металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительного компонента среды происходит не в одном акте, и их скорости зависят от электродного потенциала металла. По такому процессу протекают, например, взаимодействие металла с кислотами:
Zn + 2HCl  Zn2+ + 2Cl-+H2
Zn2+ + 2Cl-+H2
эта суммарная реакция состоит из двух актов:
Zn  Zn2+ +2ē
Zn2+ +2ē
2Н++2ё  Н2
Н2
Дата добавления: 2015-07-11; просмотров: 132 | Нарушение авторских прав