
Читайте также:
|
Важнейшим применением электролиза является извлечение с его помощью ряда химических элементов из природного сырья. Например, хлор, водород и натрий получают путем электролиза соляных растворов или расплавленного NaCl. Почти весь вырабатываемый в настоящее время алюминий – продукт электролиза раствора Al2O3 в криолите. Предпочтительный вариант диссоциации Al2O3 в расплаве криолита (Na3[AlF6]): 2 Al2O3 = Al3+ + 3 AlO2−
определяет следующие электродные процессы (Федотьев):
A: 2AlO2- = Al2O3 + O + 2e- ; K: Al3+ + 3e- = Al.
Выделяющийся на аноде кислород окисляет "жертвенный" графитовый электрод.
Расплавленный MgCl2 путем электролиза превращается в магний и хлор.
Окончательная стадия получения меди – ее электрорафинирование. Элементы с более низким, чем медь, окислительным потенциалом, как, например, серебро золото и платина, не способны окисляться на аноде и стекают с него на дно ванны, а элементы, имеющие более низкий восстановительный потенциал по сравнению с медью, не могут восстанавливаться на катоде и остаются в растворе. Процесс ведется так, что только медь окисляется на аноде и восстанавливается на катоде, где благодаря этому получается медь высокой степени чистоты.
Процесс электроосаждения металлов основан на общих законах электрохимии, однако для нанесения хороших покрытий необходимо соблюдать столько мер предосторожности, что эта техника порой граничит с искусством. Хорошего серебряного покрытия можно добиться при работе с цианидным комплексом серебра Ag(CN)2−, он позволяет поддерживать очень низкую концентрацию ионов Ag+, благодаря чему достигается осаждение серебра равномерным и плотно прилегающим слоем. В других случаях для обеспечения высоких свойств электропокрытий приходится вводить в раствор такие добавки, как сахар, крахмал и мочевину.
Среди гальванических элементов - несомненный лидер по использованию – элемент Лекланше (1865 г.), известный всем под названием сухого элемента. Цинковый сосуд, в котором помещается этот элемент, представляет собой анод; катодом служит угольный стержень. Электролит содержит мелко размельченный MnO2, а также хлорид аммония; оба эти вещества участвуют в восстановительной реакции.
Гальваническому элементу − Zn│ZnCl2 + NH4Cl + MnO2│C +
соответствует токообразующая реакция
Zn + 2 MnO2 + 2 NH4Cl → [Zn (NH3)2]Cl2 + 2 MnO(OH), E o = 1,55 ÷ 1,85 B.
Сухой элемент практически невозможно регенерировать или перезарядить, поэтому его называют первичным элементом.
Вторичные элементы (аккумуляторы) основаны на обратимых электродных реакциях. Принципы работы наиболее распространенного из них - свинцового и его электродные реакции мы уже рассмотрели. Добавим, что он создан Планте в 1859 г. но до сих пор по распространенности держит явное первенство, благодаря дешевизне, возможности работать в разных режимах. Ресурс стартерных 100 ÷ 300 циклов, тяговых 300÷1500. Е о = 1,95 ÷2,15.
Второе место среди аккумуляторов держат щелочные.
NiO(OH) +1/2 M{Cd, Fe(II), Zn} + H2O = Ni (OH)2 + 1/2 M (OH)2
NiO(OH) +H2О + e- → Ni (OH)2 + OH− ~ 0,6 B;
Cd(OH)2 + 2 e- ← Cd + 2 OH− -0,81 B
Среди перспективных конструкций отметим серно-натриевый:
3S + 2Na = Na2S3 (300 ÷ 3500C) Е о = 2,08 В.
Проблема − в изготовлении пластин керамического электролита NaAlO2 с проводимостью по катионам Na+.
Металлогидридный:
H2O + e- ← ½ H2 + OH−
NiO(OH) +H2О + e- → Ni (OH)2 + OH −
½ H2 + NiO(OH) = Ni (OH)2
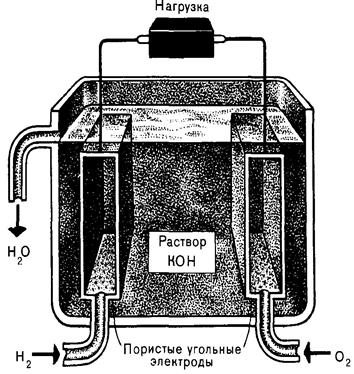
| Непрерывно действующей разновидностью гальванического элемента является топливный элемент (ТЭ), в котором химическая энергия окисления (сгорания) топлива по электрохимическому механизму превращается в электрическую, а не тепловую. КПД тепловых электростанций менее 40%. КПД ТЭ принципиально может достигать 100%. A: H2 + 2OH - → 2H2O + 2e– K: 1/2O2 + H2O + 2 e–→ 2OH– H2 + 1/2O2 → H2O E o (1атм) = 1,229 (25 оС); 1,162 (100 оС) |
| Рис. 5.13. Топливный электрохимический элемент на водороде и кислороде |
Разрабатываются среднетемпературные ТЭ с фосфорнокислым электролитом и другие для использования не ОСЧ, а технического водорода. В США и Японии есть действующие электростанции мощностью ~ 10 МВт.
Развивается направление по созданию биохимического ТЭ, в котором используются ферменты и мембраны, обладающие селективной проницаемостью для катионов и анионов.
Дата добавления: 2015-07-11; просмотров: 171 | Нарушение авторских прав