
Читайте также:
|
Тема: Получение комплексных соединений.
Вариант 1.
Получение сульфата тетраамминмеди (II).
6 г медного купороса растворите в 10 мл дистиллированной воды. Нагрейте раствор до кипения, после чего при энергичном перемешивании стеклянной палочкой постепенно прибавьте к нему концентрированный раствор аммиака, пока не раствориться выпавший вначале голубой осадок.
Затем к полученному раствору прилейте небольшими порциями 5 мл этилового спирта. Выделившиеся кристаллы комплексной соли отфильтруйте через воронку Бюхнера, высушите между листами фильтровальной бумаги и взвесьте в бюксе с крышкой. Вычислите массовую долю выхода комплексной соли.
Вариант 2.
Синтез хлорида гексамминникеля (II)
5 г хлорида никеля растворите в небольшом количестве дистиллированной воды. К раствору прибавьте концентрированный раствор аммиака до полного растворения выпавшего осадка. Через образовавшийся раствор пропустите сильный ток воздуха в течение 20 - 30 минут для окисления присутствующих примесей кобальта. Отфильтруйте раствор.
Приготовте 20 мл аммиачного раствора хлорида аммония (10 мл концентрированного раствора аммиака и 10 мл концентрированного раствора хлорида аммония). 12 мл этого раствора добавте к фильтрату, а оставшийся раствор используйте при промывании полученных кристаллов комплексной соли.
Отфильтруйте осадок на воронке Бюхнера, промойте 2-3 раза небольшими порциями раствора хлорида аммония, затем концентрированным раствором аммиака, а затем небольшим количеством этилового спирта.
Соль высушите между листами фильтровальной бумаги, взвесте в закрытом бюксе, вычислите массовую долю выхода комплексной соли.
Вариант 3.
Получение хлорида хлоропентаамминкобальта (III).
5 г кристаллогидрата хлорида кобальта (II) растворите в небольшом количестве дистиллированной воды. К раствору прибавьте 25%-ный раствор аммиака до полного растворения выпавшего осадка.
Приготовьте 10 мл концентрированного раствора хлорида аммония. Этот раствор добавьте к фильтрату вместе с 10 мл 30 % - ного раствора пероксида водорода. Красные кристаллы полученной комплексной соли плохорастворимы в воде. Отфильтруйте их через воронку Бюхнера, промойте 2-3 раза небольшими порциями холодной воды. Кристаллы высушите между листами фильтровальной бумаги и взвесьте в бюксе с крышкой. Вычислите массовую долю выхода комплексной соли.
Вариант 4.
Получение диметилглиоксимата никеля.
Химическая связь в комплексных соединениях с позиции теории кристаллического поля. Эффект Яна – Теллера.
Теория кристаллического поля предсказывает, что когда в октаэдрическом поле лигандов на d γ- подуровне центрального атома одна орбиталь занята неспаренным электроном или парой электронов, а вторая орбиталь свободна, то происходит снятие энергетического вырождения d γ-подуровня (разделение дважды вырожденного дублета на два невырожденных синглета) - эффект Яна-Теллера.
В слабом поле лигандов это имеет место для центральных атомов с конфигурацией d ε3 d γ1 и в сильном поле лигандов - для центральных атомов с конфигурациями d ε6 d γ1 и d ε6 d γ2:
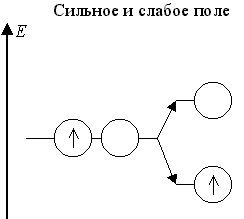
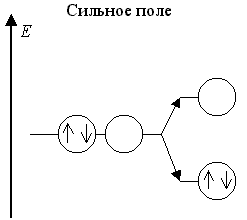
Оставшаяся свободной d γ-АО участвует в dsp 3 d -гибридизации. Примерами октаэдрических частиц с такими центральными атомами в слабом поле являются комплексы [CrII(H2O)6]2+ и [MnIII(C2O4)3]3-, а в сильном поле [CoII(NO2)6]4- и [NiII(NO2)6]4-.
В геометрическом смысле эффект Яна - Теллера приводит к тетрагональному искажению октаэдрической формы комплексов [ML6] с dsp 3 d -гибридизацией орбиталей центрального атома, т.е. чаще всего к удлинению двух осевых связей M - L и укорочению четырех экваториальных связей M - L (реже - наоборот). Большое тетрагональное искажение приводит к октаэдру, сильно вытянутому вдоль выбранной оси. Поэтому наблюдается почти полное исчезновение влияния двух осевых лигандов, и в гибридизации прекращается участие одной np - и одной nd -АО.
Формула гибридизованных орбиталей уменьшается на pd, т.е. реализуется dsp 2-гибридизация.

В этом случае октаэдрический комплекс [ML6] фактически превращается в плоскоквадратный [ML4]. При этом снимается также вырождение d ε-подуровня. Поэтому, например, атом NiII в сильном поле лигандов чато образует не октаэдрические, а плоскоквадратные комплексы типа [Ni(CN)6]2-, а для центральных атомов PdII и PtII все комплексы будут плоскоквадратными
1. Укажите, какие из перечисленных комплексов диамагнитны, а какие - парамагнитны:
а) [Sc(OH)6]3-; б) [Ti(H2O)6]3+; в) [TiCl6]2-г) [CuCl5]3-; д) [Cu(OH)6]4-; е) [V(H2O)6]3+ж) [VCl4]-; з) [VF6]-; и) [Cu(CN)4]2-
Ваши ответы аргументируйте.
2. Используя теорию кристаллического поля, определите, будут ли диамагнитными или парамагнитными следующие октаэдрические комплексы, в которых лиганды создают сильное поле:
а) [Co(H2O)2(CN)4]-; б) [Mn(CN)6]4-; в) [Cr(NO)(CN)5]3-г) [Co(en)3]3+; д) [Fe(CN)6]4-; е) [Co(NO2)6]4-ж) [Fe(CN)6]3-; з) [Mn(CN)6]3-; и) [Cr(CN)6]6-
Укажите число неспаренных электронов у центрального атома в парамагнитных комплексах.
3. Используя теорию кристаллического поля, установите, будут ли диамагнитными или парамагнитными следующие октаэдрические комплексы, в которых лиганды создают слабое поле:
а) [Co(NH3)6]2+; б) [Mn(C2O4)3]3-; в) [Fe(H2O)F5]3-г) [Cr(H2O)6]2+; д) [CoF6]3-; е) [Mn(H2O)6]2+
Укажите число неспаренных электронов у центрального атома в парамагнитных комплексах.
4. В комплексах [Co(NO2)6]4- и [Ni(NCS)6]4- лиганды обладают сильным полем. Составьте энергетическую схему образования связей в этих комплексах и укажите магнитные свойства комплексов.
Дата добавления: 2015-09-05; просмотров: 132 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Определение знака заряда коллоидных частиц методом капиллярного и капельного анализа | | | Пояснительная записка. |