
Читайте также:
|
Е524 – Гидроксид натрия
Одному хорошему человеку нужна Ваша помощь. Подробности здесь.
Другие названия добавки (синонимы)
Е524
Гидроксид натрия (пищевая добавка E524) – белое твердое вещество, слегка скользкое на ощупь, сильная щелочь, получаемая путем электролиза из хлорида натрия. Имеет свойство поглощать углекислый газ, находящийся в атмосфере, образовывая корку карбоната натрия. В соединениях со спиртами образует алкоголяты. Гидроксид натрия разрушает материалы органического происхождения, такие как кожа, бумага, дерево. Химическая формула: NaOH. При попадании на кожу гидроксид натрия вызывает сильные химические ожоги, пораженный участок необходимо сразу же промыть большим количеством воды. При попадании внутрь вызывает ожоги полости рта, гортани, пищевода и желудка, во время лечения нужно пить как можно больше воды (молока или любой другой жидкости) и ставить очищающие клизмы. Иногда гидроксид натрия используется для нелегального производства наркотических средств. В пищевой промышленности гидроксид натрия используется в качестве регулятора кислотности при производстве какао, шоколада, мороженого, безалкогольных напитков и карамели. Применяется для размягчения маслин и добавляется в хлебобулочную продукцию. С помощью каустика готовятся некоторые блюда, например, перед выпечкой немецких рогаликов, их обрабатывают раствором едкой щелочи, для образования хрустящей корочки. А для приготовления скандинавского блюда из рыбы – лютефиска – сушеную теску вымачиваю в щелочи в течение пяти дней, для того, чтобы рыба приобрела желеобразную консистенцию. Другие использования гидроксида натрия: - в промышленных процессах, например для омыления жиров, или обработки бокситов для получения алюминия; - в косметической промышленности, в качестве щелочной и эмульгирующей добавки в мыле, шампунях, кремах, жидкостях для снятия лака; - в целлюлозно-бумажной промышленности; - в химической промышленности, для нейтрализации кислот и кислотных окислов; - в нефтеперерабатывающей промышленности, для производства масел; - для изготовления биодизельного топлива; - в гражданской обороне, для нейтрализации отравляющих веществ или дегазации; - для растворения засоров канализационных труб, в качестве одно из компонентов геля.
Натрия гидроксид Гидроксид натрия, известный также как каустическая сода, является одной из самых распространенных щелочей, которая представляет собой твердый белый или чуть желтоватый порошок. Это вещество активно используется в промышленном производстве и для бытовых нужд. Свойства гидроксида натрия В быту гидроксид натрия также называют едкой щелочью или едким натром. Это связано с тем, что данное вещество имеет свойство разъедать многие материалы и органические вещества: кожу, бумагу и даже некоторые металлы. Кроме того, каустическая сода обладает и такими характеристиками: Гигроскопичность – способность поглощать влагу из воздуха, этим объясняется тот факт, что гидроксид натрия расползается на открытом воздухе, вбирая в себя водяные пары. Такое вещество необходимо хранить в плотно закрытой упаковке в защищенном от влажности месте; Едкая щелочь растворяется в воде, при этом выделяя большое количество тепла. Раствор каустической соды напоминает жидкое мыло, он немного скользкий на ощупь; Гидроксид натрия хорошо растворяется в этаноле и метаноле, именно поэтому спиртовые растворы данного вещества также широко распространены; Температура плавления каустической соды – 318 градусов, а температура кипения – 1390; Едкий натр при контакте с некоторыми металлами (цинк, свинец, олово, алюминий) может образовывать взрывоопасный горючий газ (водород); Очень опасна каустическая сода в соединении с аммиаком. С одной стороны, эти свойства гидроксида натрия делают его опасным при несоблюдении мер предосторожности при обращении со щелочью, но с другой – значительно расширяют область его применения. Области применения гидроксида натрия Как уже отмечалось выше, каустическая сода – самая распространенная щелочь, ежегодно производится порядка 56-58 миллионов тонн этого вещества. Чаще всего гидроксид натрия представлен в виде рассыпчатого порошка, но может встречаться и в форме различных растворов (химических, ртутных, диафрагменных). Каким же целям служит гидроксид натрия? В целлюлозно-бумажной промышленности едкий натр активно используется в процессе изготовления картона, бумаги, древесно-волоконных плит; Производство необходимых каждому из нас мыла и шампуня не обходится без гидроксида натрия, который используется для омыления жиров; В химической промышленности едкий натр – незаменимый элемент, который позволяет нейтрализовать кислоты и служит отличным катализатором многих химических реакций; Нефтеперерабатывающая промышленность использует каустическую соду для производства масел; Гидроксид натрия применяется в качестве катализатора в процессе изготовления биодизельного топлива; Канализационные трубы имеют неприятную особенность время от времени засоряться, с этой проблемой отлично может справиться каустическая сода благодаря своей способности разъедать многие твердые вещества. Гидроксид натрия часто входит в состав гелей или сухих гранул, предназначенных для устранения засоров; Даже гражданская оборона использует едкий натр в своих целях: это вещество способно нейтрализовать действие отравляющих газов, поэтому его применяют в изолирующих дыхательных аппаратах для очистки воздуха от углекислого газа; Пищевая промышленность применяет гидроксид натрия для освобождения овощей и фруктов от корочки, в производстве шоколада и какао. Мало кто знает, что для размягчения маслин и придания им темного цвета также используется каустическая сода. Многие хлебобулочные изделия перед выпеканием обрабатываются раствором едкого натра, что позволяет добиться хрустящей и румяной корочки; Косметические процедуры по удалению нежелательных ороговевших участков кожи (бородавок, папиллом и т.д.) проводятся с применением гидроксида натрия. Как обращаться с гидроксидом натрия Каустическая сода при неправильном обращении может нанести серьезный ущерб здоровью, неслучайно ее называют едкой щелочью и относят ко второму классу опасности. Попадая на слизистые оболочки, гидроксид натрия вызывает сильнейшие химические ожоги. Очень опасно попадание каустической соды в глаза: чаще всего это способствуют атрофии зрительного нерва, приводящей к потере зрения. Зачастую какие-либо бытовые ситуации сталкивают с необходимостью применения гидроксида натрия, при работе с ним нужно: Всегда работать в перчатках, химических брызгозащитных очках, а для защиты тела использовать химически стойкую одежду, пропитанную винилом, или прорезиненные костюмы; При попадании гидроксида натрия на слизистую оболочку необходимо срочно промыть поврежденный участок струей теплой проточной воды, а при попадании на кожу – слабым уксусным раствором.
Источник: http://selderey.net/pravilnoe-pitanie/natrija-gidroksid.html
Гидроксид натрия
[править | править вики-текст]
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 июля 2014; проверки требует 1 правка.
| Гидроксид натрия | |

| |
| |
| Общие | |
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щелочь |
| Хим. формула | NaOH |
| Физические свойства | |
| Молярная масса | 39,997 г/моль |
| Плотность | 2,13 г/см³ |
| Термические свойства | |
| Т. плав. | 323 °C |
| Т. кип. | 1403 °C |
| Химические свойства | |
| Растворимость в воде | 108,7 г/100 мл |
| Классификация | |
| Рег. номер CAS | 1310-73-2 |
| PubChem | |
| Рег. номер EINECS | 215-185-5 |
| SMILES | [показать] |
| RTECS | WB4900000 |
| ChemSpider | |
| Безопасность | |
| Токсичность |  ALK
ALK
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иначе. |
Гидроксид натрия (лат. Natrii hydroxidum; другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется более 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разъедать кожу, бумагу, и другие органические вещества, вызывая сильные ожоги. До XVII века щёлочью (фр. alkali) называли также карбонаты натрия и калия. В 1736 г. французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой (по растению Salsola Soda из рода Солянка, из золы которого её добывали), а карбонат калия — поташем. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
[убрать]
· 1 Физические свойства
· 2 Химические свойства
· 3 Качественное определение ионов натрия
· 4 Методы получения
o 4.1 Химические методы получения гидроксида натрия
§ 4.1.1 Известковый метод
§ 4.1.2 Ферритный метод
o 4.2 Электрохимические методы получения гидроксида натрия
§ 4.2.1 Диафрагменный метод
§ 4.2.2 Мембранный метод
§ 4.2.3 Ртутный метод с жидким катодом
§ 4.2.4 Лабораторные методы получения
· 5 Рынок каустической соды
· 6 Применение
· 7 Меры предосторожности при обращении с гидроксидом натрия
· 8 Литература
· 9 Примечания
Физические свойства[править | править вики-текст]
Гидроксид натрия NaOH — белое твёрдое вещество. Если оставить кусок едкого натра на воздухе, то он вскоре расплывается, так как притягивает влагу из воздуха. Едкий натрий хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
Термодинамика растворов
Δ H0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при 12,3—61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH0обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = 28 °C), в этаноле 14,7 г/л (t = 28 °C). NaOH·3,5Н2О (температура плавления 15,5 °C);
Химические свойства[править | править вики-текст]
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельныхметаллов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит),LiOH, RbOH, CsOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.

Водные растворы NaOH имеют сильную щелочную реакцию (pH1%-раствора = 13). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH−), (cфенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в реакции:
1.Нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ:
· c кислотами — с образованием солей и воды:
NaOH + HCl → NaCl + H2O
(1) H2S + 2NaOH = Na2S + 2H2O (при избытке NaOH)
(2) H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH− +H3O+ → 2H2O.)
· с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твёрдыми при сплавлении:
ZnO + 2NaOH → Na2ZnO2 + H2O
так и с растворами:
ZnO + 2NaOH(раствор) + H2O → Na2[Zn(OH)4](раствор)
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора — тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
· С амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
2. Обмена с солями в растворе:
2NaOH +CuSO4 → Cu (OH)2↓ + Na2SO4,
2Na+ + 2OH− + Cu2+ + SO42− → Cu(OH)2↓+ Na2SO4
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4.
6Na+ + 6OH− + 2Al3+ + SO42− → 2Al(OH)3↓ + 3Na2SO4.
3. С неметаллами:
например, с фосфором — с образованием гипофосфита натрия:
4Р + 3NaOH + 3Н2О → РН3 + 3NaH2РО2.
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
· с галогенами:
2NaOH + Cl2 → NaClO + NaCl + H2O (дисмутация хлора)
2Na+ + 2OH− + 2Cl− → 2Na+ + 2O2− + 2H+ + 2Cl− → NaClO + NaCl + H2O
6NaOH + 3I2 → NaIO3 + 5NaI + 3H2O
4. С металлами: Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксиалюмината натрия и водорода:
2Al0 + 2NaOH + 6H2O → 3H2↑ + 2Na[Al(OH)4]
2Al0 + 2Na+ + 8OH− + 6H+ → 3H2↑ + 2Na+[Al3+(OH)−4]−
5. С эфирами, амидами и алкилгалогенидами (гидролиз):
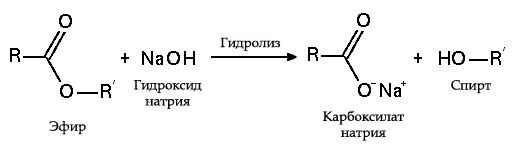
Гидролиз эфиров
с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:
(C17H35COO)3C3H5 + 3NaOH → C3H5(OH)3 + 3C17H35COONa
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
6. С многоатомными спиртами — с образованием алкоголятов:
HO-CH2-CH2ОН + 2NaOH → NaO-CH2-CH2-ONa + 2Н2O
7. Со стеклом: в результате длительного воздействия горячей гидроокиси натрия поверхность стекла становится матовой (выщелачивание силикатов):
SiO2 + 4NaOH → (2Na2O)·SiO2 + 2H2O.
Качественное определение ионов натрия[править | править вики-текст]

Ионы натрия придают пламени жёлтую окраску
1. По цвету пламени горелки — ионы натрия придают пламени жёлтую окраску
2. С использованием специфических реакций на ионы натрия
| Реагент | Фторид аммония | Нитрит цезия-калия-висмута | Ацетат магния | Ацетат цинка | Пикро- лоновая кислота | Диокси- винная кислота | Бромбензол- сульфокислота | Ацетат уранила-цинка |
| Цвет осадка | белый | бледно-жёлтый | жёлто-зелёный | жёлто-зелёный | белый | белый | бледно-жёлтый | зеленовато-жёлтый |
Методы получения[править | править вики-текст]
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия [править | править вики-текст]
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод [править | править вики-текст]
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашенной известью при температуре около 80 °С. Этот процесс называется каустификацией; он проходит по реакции:
Na2СО3 + Са (ОН)2 = 2NaOH + CaСО3
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод [править | править вики-текст]
Ферритный метод получения гидроксида натрия состоит из двух этапов:
1. Na2СО3 + Fe2О3 = 2NaFeО2 + СО2
2. 2NaFeО2 + xH2О = 2NaOH + Fe2O3*xH2О
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия [править | править вики-текст]
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
| Выход хлора, % | 98,5 | ||
| Электроэнергия, кВт·ч | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH, % | |||
| Чистота хлора, % | 99,2 | 99,3 | |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl− в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод [править | править вики-текст]
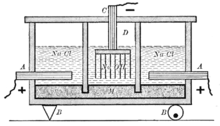
Схема старинного диафрагменного электролизера для получения хлора и щёлоков: А — анод, В — изоляторы, С — катод, D — пространство заполненное газами (над анодом — хлор, над катодом — водород), М — диафрагма
Наиболее простым, из электрохимических методов, в плане организации процесса и конструкционных материалов для электролизера, является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую, иногда, добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Противоток — очень важная особенность устройства диафрагменного электролизера. Именно благодаря противоточному потоку направленному из анодного пространства в катодное через пористую диафрагму становится возможным раздельное получение щёлоков и хлора. Противоточный поток рассчитывается так, чтобы противодействовать диффузии и миграции OH- ионов в анодное пространство. Если величина противотока недостаточна, тогда в анодном пространстве в больших количествах начинает образовываться гипохлорит-ион (ClO-), который, затем, может окисляться на аноде до хлорат-иона ClO3-. Образование хлорат-иона серьёзно снижает выход по току хлора и является основным побочным процессом в этом методе получения гидроксида натрия. Также вредит и выделение кислорода, которое, к тому же, ведёт к разрушению анодов и, если они из углеродных материалов, попаданию в хлор примесей фосгена.
Анод:
2Cl− — 2е− → Cl2↑ — основной процесс
2H2O — 2e- → O2↑+4H+
6СlО- + 3Н2О — 6е- → 2СlО3- + 4Сl- + 1,5O2↑ + 6Н+
Катод:
2H2O + 2e− → H2↑ + 2OH− — основной процесс
СlО- + Н2О + 2е- → Сl- + 2ОН-
СlО3- + 3Н2O + 6е- → Сl- + 6OН-
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок, поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типабишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод [править | править вики-текст]
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из катодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из анодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Схема мембранного электролизера.
Ртутный метод с жидким катодом [править | править вики-текст]
В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом. Щёлоки, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (для некоторых производств это критично). Например, в производстве искусственных волокон можно применять только высокочистый каустик), а по сравнению с мембранным методом организация процесса при получении щёлочи ртутным методом гораздо проще.
Схема ртутного электролизёра.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
2Cl− — 2е− → Cl20↑ — основной процесс
2H2O — 2e- → O2↑+4H+
6СlО- + 3Н2О — 6е- → 2СlО3- + 4Сl- + 1,5O2↑ + 6Н+
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Na+ + е = Na0
nNa+ + nHg− = Na + Hg
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Na + Hg + Н2O = NaOH + 1/2Н2↑ + Hg
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Однако, полная очистка раствора щелочи от остатков ртути практически не возможна[ источник не указан 759 дней ], поэтому этот метод сопряжён с утечками металлической ртути и её паров.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щелочи с твёрдым катодом, в особенности мембранным методом.
Лабораторные методы получения [править | править вики-текст]
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизёр диафрагменного или мембранного типа.
Рынок каустической соды[править | править вики-текст]
Мировое производство натра едкого, 2005 г. [ источник не указан 493 дня ]
| Производитель | Объём производства, млн. тонн | Доля в мировом производстве, % |
| DOW | 6,363 | 11,1 |
| Occidental Chemical Company | 2,552 | 4,4 |
| Formosa Plastics | 2,016 | 3,5 |
| PPG | 1,684 | 2,9 |
| Bayer | 1,507 | 2,6 |
| Solvay | 1,252 | 2,2 |
| Akzo Nobel | 1,157 | |
| Tosoh | 1,110 | 1,9 |
| Arkema | 1,049 | 1,8 |
| Olin | 0,970 | 1,7 |
| Россия | 1,290 | 2,24 |
| Китай | 9,138 | 15,88 |
| Другие | 27,559 | 47,87 |
| Всего: | 57,541 |
В России согласно ГОСТ 2263-79 производятся следующие марки натра едкого:
ТР — твёрдый ртутный (чешуированный);
ТД — твёрдый диафрагменный (плавленый);
РР — раствор ртутный;
РХ — раствор химический;
РД — раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
| Внешний вид | Чешуированная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристаллизованный осадок |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
Показатели российского рынка жидкого натра едкого в 2005—2006 г. [ источник не указан 493 дня ]
Дата добавления: 2015-08-17; просмотров: 162 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Упражнение № 1 | | | Показатели российского рынка твёрдого натра едкого в 2005—2006 г. |