
Читайте также:
|
70. Геохимия Sn. Распространённость. Поведение в гидротермальном процессе. Парагенетические отношения с B, Mo, W и др. элементами.
Олово (Sn) - элемент главной подгруппы IV группы, 5 периода, с атомным номером 50. Сидерофильный химический элемент, проявляет металлические свойства. Кларковое содержание олова в земной коре составляетот 2*10-4 до 8*10-3 % по массе. Основной минерал олова — касситерит SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин — Cu2FeSnS4 (27,5 % Sn).
Земная кора не обогащена Sn, пo сравнению с метеоритами. Sn меньше, чем Cd в земной коре из-за сидерофильности (ушло в ядро). В ходе магматической эволюции - некогерентный химический элемент. Устойчивые валентности +2 и +4: Sn2+ (основание), Sn4+ (амфотерный катион), близкий к слабым ангидритам. Обладает сродством к O2, S, F, Cl. Гидрид (SnH4) неустойчив. Характерны оловоорганические соединения, термическиустойчивые и летучие. Соединения Sn2+ более растворимы вН2О. оксиды SnO2 и SnO практически нерастворимы. В растворах соли: Sn2+ легко окисляются, а соли Sn4+ легко гидрализуются.
Минералогия: Известно более 100 минералов олова: халькогениды, сульфиды, сульфоарсениды, сульфоантимониды, самородное олово и его интерметаллиды, гидроксиды, оксиды, силикаты, бораты, гидробораты, гндрохлориды. В халькогенидах соединениях Sn чаще всего ассоциирует с Fe, иногда с РЬ и Ge, в интерметаллидах - с Pb, Sb, Pt, Pd.
Содержание элементов-примесей в касситерите зависит от типа месторождения, генерации минерала и его положение относительно рудообразуещего массива. Наиболее высокие концентрации Та, Nb, Sc типичны для касситеритов из пегматитов и рудоносных гранитов. In и Ga - для силикатно-сульфидных и сульфидных руд. Отмечается структурная близость SnO2 и TiO2. Среди минералов других элементов Sn частно встречается в оксидах Ta и Ti, особенно в сфене, ильмените, рутиле, турмалине, сфалирите, пирите, пирротине. Олово концентрируется в высокотемпературных гидротермальных процессах (грейзены). Кассетеритовые россыпи.
Олово обогащает больше кислые породы, чем основные.олово сидит в биотите в гранитах, собственной фазы там нет. при мусковитизации биотита выдел касситерит (включения в мусковитовых пластинках). Морская вода не обогащается оловом, т.к. он уходит в осадок. Олово в глинах рассеивается. Присутствует в черных сланцах.
радиогенный изотоп 115Sn <- 115In/ фракцион изотопов олово не обнаружено.
71. Водород. Процессы генерирующие H2. Изотопы. Водород в породах. Потеря H2 Землей.
Изотопы: 11Н; 21D; [3T]. p/a t1/2 = 12.5 лет космосинтез
31Т – образуется при термоядерных взрывах.
Н и D – стабильные изотопы.
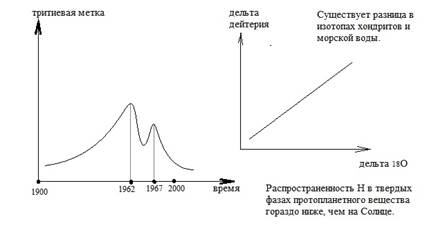
Н/D = 6800 (протий/дейтерий). Стандарт морской воды (V) – SMOW. Органические вещества- малая доля Н2.
Изучается реликтовое излучение от большого взрыва. Тяжелые частицы получили массу и + заряд. Загадка, почему мы не получили симметрии (достаточного количества антипротонов и антинейтронов). Образовались элементы до Li, всё остальное –продукты нуклеосинтеза (происходит в звездах). Основа- Н, распространение между Солнцем и метеоритами не пропорционально: метеориты обеднены, в Солнце Н - топливо, циклические реакции (углеродный цикл), а не реакции прямого синтеза (как в тяжелых звездах).
Самый распространенный химический элемент во Вселенной (более 70%). Н2- газ, но образует много соединений. Около 1,5 тыс. водородосодержащих минералов. Также в основе Н2О, которая входит в метеориты –> минералогия Н- это минералогия водосодержащих минералов. Другие соединения: аммоний, органика, НСО3,…
Кристаллогидраты: CaSO4*2H2O (при низкой Т соли образуют кристаллогидраты)
В метеоритах Н2О есть:
Хондриты – 1,5-2%
Углистые хондриты (минер. Серпентин,хлорит) – больше 2% (по лекциям из группы содержание Н 10-12%?!)
Кометы – во внутренней части Солнечной системы, облако Оорта, есть Юпитерианские.
Водород растворяется в силикатных расплавах: Н2О = Н2 +1/2 О2
Атмосфера не удерживает легкие газы (с атомной массой <7), Н2 диссипирует в космос.
Свободный водород выделяется при
1) хим.реакции - серпентинизации и в других процессах (например, в гидротермальных системах): Ol + H2O –> Serp + Mt+ H2
2) деятельности бактерий
3) глубинный Н
Интересно, что на ближайших к Земле планетах воды нет. На Земле- дофига. Fe2O3 + Н2= FeO+ H2O.
Дата добавления: 2015-08-17; просмотров: 332 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Геохимия TR и Y . Лантаноидное сжатие. Значение этого факта. Y и Ce группы. Изоморфные отношения. Разные спектры редких земель и их объяснение. | | | ЧТО ТАКОЕ МАГИЯ? КАКОВЫ ЕЕ ЧАСТИ И КАКИМ ДОЛЖЕН БЫТЬ ТОТ, КТО ЗАНИМАЕТСЯ ЕЮ? |