
Многие природные и синтетические полимеры содержат в составе элементарных звеньев своих макро молекул различные ионогенные функциональные группы, способные диссоциировать в водных растворах. Такие вещества называются высокомолекулярными электролитами, или полиэлектролитами. При их диссоциации образуются небольшие подвижные ионы и многозарядный полимерный макроион. По характеру диссоциации ионогенных групп полиэлектролиты можно разбить на следующие 3 вида.
1. Полиэлектролиты, содержащие в своем составе только кислотные группы, диссоциирующие с отщеплением иона Н+, например –COOH, –SO3H, –SH. Из природных полимеров к таким полиэлектролитам относятся агар, окисленный крахмал, пектин. В состав макромолекул агара входят сульфогруппы, а элементарные звенья окисленного крахмала и пектина содержат карбоксильные группы. В некоторых полимерах ион водорода в этих группах может быть замещен на катион металла.
2. Полиэлектролиты, макромолекулы которых содержат тольео основные группы, например аминогруппу –NH2. Среди биополимеров таких соединений нет. Данные полиэлектролиты получают синтетическим путем. К ним относятся многие анионообменные смолы (аниониты), имеющие большое практическое значение.
3. Полиэлектролиты, в макромолекулах которых чередуются кислотные и основные группы.Такие полиэлектролиты можно назвать полимерными амфотерными электролитами, или полиамфолитами. К ним относятся самый сложный и самый важный для живых организмов класс полимеров – белки.
Наличие в макромолекулах белков двух свободных ионогенных групп: основной –NH2 и кислотной –COOH – придает им амфотерные свойства. В водных растворах белок может диссоциировать и как кислота и как основание:
Pt–COOH ↔ Pt–COO– + H+
Pt–NH2 + HOH ↔ Pt–NH3+ + OH–
В кислой среде, содержащей избыток ионов Н+ ионизация СООН-групп будет подавлена и макромолекула белка приобретет положительный заряд за счет ионизации амино-групп.
В щелочной среде, наоборот, будет подавляться процесс протонирования NH2-групп, зато практически полностью продиссоциируют СООН-группы. Белок будет вести себя как кислота и его молекулы приобретут отрицательный заряд.
Очевидно, должна существовать такая концентрация ионов Н+ в растворе, при которой число ионизированных кислотных групп в молекуле белка будет равно числу ионизированных основных групп. Суммарный же электрический заряд такой макромолекулы станет равным нулю. Данное состояние белка в водном растворе называется изоэлектрическим состоянием, а значение рН раствора при котором молекула белка находится в изоэлектрическом состоянии его изоэлектрической точкой (I).
Большинство природных белков содержит в пептидной цепи значительные количества остатков дикарбоновых аминокислот (аспарагиновой, глутаминовой). Такие белки называются кислотными. Изоэлектрическая точка кислотных белков лежит в области рН < 7. Для ее достижения в раствор белка нужно ввести некоторое количество сильной кислоты, чтобы подавить диссоциацию части карбоксильных групп.
Нейтральные белки содержат в своих макромолекулах примерно равное количество кислотных и основных групп. Они переходят в изоэлектрическое состояние непосредственно в ходе своего растворения и не требуют для этого добавления сильной кислоты либо щелочи. Для них I ≈ 7.
В молекулах оснóвных белков NH2-групп содержится больше чем кислотных. Для перевода их в изоэлектрическое состояние в раствор нужно добавить какое-то количество щелочи, чтобы депротонировать избыточные оснóвные группы. Соответственно электрическая точка основных белков лежит в области рН > 7.
От реакции среды и характера диссоциации белковой молекулы зависит ее форма в растворе. При диссоциации ионогенных групп только по кислотному или только по основному типу в изогнутой спиралью пептидной цепи появятся одноименные заряды, распределенные по всей ее длине. За счет возникающих электростатических сил расталкивания соседние витки спирали будут стремится удалиться друг от друга. В результате этого макромолекула будет растягиваться.
В изоэлектрическом состоянии вдоль пептидной цепи чередуются заряды противоположного знака, способствующие сжатию молекулы или даже скручиванию ее в глобулу (рис. 79б).
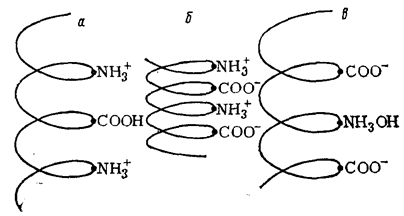
Рис. 79. Форма макромолекулы белка в кислой среде (а), в изоэлектрической точке (б) и в щелочной среде (в)
Таким образом, в изоэлектрическом состоянии молекулы белка в растворе занимают наименьший объем. С увеличением или уменьшением рН молекулы распрямляются.
Объем макромолекул белков влияет на вязкость их растворов. В изоэлектрическом состоянии она должна быть минимальной (рис. 80). На этом свойстве растворов белков основан один из способов определения их изоэлектрической точки. Ее опытным путем можно определить еще и электрофоретическим методом. Аналогично изменению вязкости в зависимости от рН раствора протекает и процесс набухания белков. В изоэлектрической точке степень набухания белка минимальна.
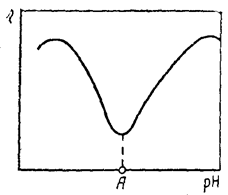
Рис. 80. Зависимость вязкости раствора белка от рН среды: А – изоэлектрическая точка белка
Дата добавления: 2015-08-02; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Свободная и связанная вода в растворах | | | Факторы, влияющие на устойчивость растворов полимеров. Высаливание |