
Читайте также:
|
Современные представления о механизме процессов на железном электродах связаны с работами Б. Н. Кабанова, С. А. Розенцвейга, Б. В. Эршлера и др. В этих работах показано, что механизм процессов на железном электродах имеет жидкофазный характер. Железо в растворах щелочи присутствуют в виде анионов HFeO2-, причем концентрация этих ионов (примерно 10-4 моль/л) и скорость растворения достаточно велики для обеспечения протекания с заметной скоростью реакций:
 Fe +ЗОН НFeО- + Н2О+2е
Fe +ЗОН НFeО- + Н2О+2е
 HFeO2 + H2O Fe(OH) 2 +OH-
HFeO2 + H2O Fe(OH) 2 +OH-
Окончание анодного процесса на железе вызвано пассивацией металлов под влиянием небольшого количества кислорода, прочно адсорбирующегося на металлах. Экспериментально найдено, что для железа это количество кислорода равно всего долям молекулярного слоя.
Восстановление гидроокиси Fe(OH)2 при заряде происходит по тому же механизму, что и образование их при разряде, т.е. через стадию растворения их с образованием соответствующих ионов, восстанавливающихся на катоде до металла.
Самозаряд щелочных аккумуляторов обусловлен в основном физико-химическими процессами, определяемыми природой электродов и электролита.
Особенностью электрохимического поведения железа является то, что в ходе его анодного растворения по реакции 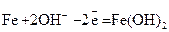 продуктом разряда является твердая фаза с низкой удельной электропроводностью. Образование данной фазы приводит к уменьшению истинной удельной поверхности активного вещества и изменяет физико-химические свойства активной массы. Следовательно, модель железного электрода должна учитывать изменение пористости, активной поверхности и размеров частиц активного вещества.
продуктом разряда является твердая фаза с низкой удельной электропроводностью. Образование данной фазы приводит к уменьшению истинной удельной поверхности активного вещества и изменяет физико-химические свойства активной массы. Следовательно, модель железного электрода должна учитывать изменение пористости, активной поверхности и размеров частиц активного вещества.
В ходе разряда, размер частиц металлического железа уменьшается и далее между ними образуется слой гидроксида железа с существенно низкой электропроводностью по сравнению с железом.
Такое модельное представление твердой фазы позволяет учесть уменьшение размера зерен активного вещества, потерю контакта между частицами электропроводного металлического железа в ходе разряда и уменьшение истинной удельной поверхности за счет ее экранирования продуктами окисления железа.
Кроме сопротивления электролита и твердой фазы на распределение тока значительное влияние может оказать величина фарадеевского сопротивления (сопротивление переносу заряда).
При анодном окислении железного электрода происходит расходование щелочи, что будет приводить к снижению времени разряда, особенно при больших плотностях разрядного тока.
Изменение концентрации электролита оказывает влияние на величину тока обмена реакции окисления железа, проводимость электролита в порах, смещение равновесного потенциала железа в щелочи. Поэтому при моделировании железного электрода необходимо учитывать концентрационные профили как по макропоре, так и по микропоре в гидроксидной пленке.
Концентрация ионов калия (натрия) определялась из условия электронейтральности раствора.
Коэффициент извилистости пор принимался обратно пропорциональным пористости электрода.
Для создания эффективного токопроводящего каркаса рекомендовано использовать в качестве электропроводящей добавки совместно с графитом сажу. Данная добавка увеличивает емкость на длительных и коротких режимах разряда, а также после длительного хранения аккумуляторов в заряженном состоянии. При указанных режимах эксплуатации содержание сажи должно составлять 4+ 8%, а графита 7%.
Повышение коэффициента использования активного вещества, особенно при больших разрядных токах, может быть достигнуто как за счет развития электрохимически активной поверхности, так и за счет изменения свойств поверхностных оксидных пленок. Для увеличения емкости железного электрода была предложена комбинированная добавка, содержащая ОПАВ и свинец. Так как развитие электрохимически активной поверхности одновременно с повышением активности основного процесса приведет и к увеличению саморазряда, улучшающие добавки добавки должны способствовать и повышению перенапряжения выделения водорода на железе. Для снижений саморазряда отрицательного свинцового электрода кислотного аккумулятора применяется а-онк. Исследование ее влияния на процесс выделения водорода на железе в щелочной среде проводилось снятием катодных поляризационных кривых на монолитном железном электроде в присутствии на его поверхности свшща и органической добавки в электролите. Свинец на поверхности железного электрода значительно уменьшает скорость выделения водорода (рис.3). Дополнительное введение а-оксинафтойной кислоты в щелочной электролит еще, более затрудняет процесс выделения водорода. В отсутствии свинца а-онк практически не оказывает влияние на величину тока выделения водорода
Таким образом, предварительные исследования поведения монолшного железного электрода в присутствии ацетата свинца и а-оксинафтойной кислоты показали, что найденную комплексную добавку целесообразно использовать в пористом электроде для снижения его саморазряда и повышения коэффициента использования активной массы.
Действительно, совместное введение в отрицательную активную массу соединений свинца и предлагаемой органической добавки повышает емкость электрода При отсутствии свинца рекомендованная органическая ПАВ не оказала влияния на электрохимические характеристии отрицательного электрода Введение только ацетата свинца в активную массу железного электрода в начальный период цитирования не повлияло на емкостные характеристики. При дальнейшем циклировании указанная добавка уже снижает время разряда на 20+22%. Однако, в присутствии свинца наблюдается небольшое снижение саморазряда. Введение дополнительно к ацетату свинца а-оксинафтойной кислоты позволило существенно повысить коэффициент использования железа и снизить потерю емкости при хранении.
Значительно улучшили электрические характеристики отрицательного электрода предложенные добавки при эксплуатации на коротких режимах разряда и при отрицательных температурах (введение ацетата свинца, а-оксинафтойной кислоты увеличило отданную емкость при комнатной температуре на -30% и в 1.8 раза при отрицательной температуре). Наиболее сильное положительное воздействие найденных добавок при таких условиях эксплуатации объясняется анализом фазового состава пористых электродов в заряженном и разряженном состоянии. Для ошытного аккумулятора наблюдается довольно быстрое накопление металлического железа в заряженном отрицательном электроде. После восьмого цикла степень заряженности стабилизируется и составляет ~ 80+85%. У контрольных электродов накопление железа происходит с меньшей скоростью. Причиной тому может бьггь повышение перенапряжения выделения водорода в присутствии найденных улучшающих добавок и соответственно
лучшая заражаемость активного вещества. Однако превышение емкости на коротких режимах разряда больше, чем увеличение степени зараженности опытной активной массы. Это может свидетельствовать о развитии поверхности активного вещества в присутствии свинца и а-оксинафтойной кислоты. Однако увеличение истинной активной поверхности препятствует существенному уменьшению коррозионных потерь металла. Наблюдаемое снижение саморазряда опытных электродов по сравнению с контрольными составляет всего 7+8%.
В качестве добавки, повышающей сохранность отрицательного электрода был выбран оксид сурьмы(Ш). Для нормальной работы железного электрода обязательным требованием является наличие в его активной массе определенного количества сульфидной серы. Поскольку ионы свинца и сурьмы, входящие в состав рекомендованной добавки могут связывать серу в соответствующие г сульфиды с очень низким произведением растворимости (ПРре3=510'18, ПРрьг^.З 10'27,ПР5Ьл3з = 1.6 10*"), количество сульфидной серы в активной массе
железного электрода, содержащей найденные улучшающие добавки должно быть увеличило до 0.35+0.5%Б2'/Ре.
Таким образом, для получения прессованного железного электрода с повышенными емкостными характеристиками можно рекомендовать следующий состав активной массы: Ре304 + 5+7%графит + 4+8%сажа + 0.25+0.5%82'/Ре + 0.4+0.5%РЬ(СН3СОО)2 + 0.2+0.4%а-опк + 1+3%5ЬгО,/Ре. Такие электроды даже при использовании в качестве активного вещества природного магнетита без добавления искусственного оксида железа имеют высокий коэффициент использования. (на средних режимах разряда до 40%; на интенсивных - 15+16%) и потерю емкости за 1 месяц хранения при комнатной температуре —40%.
Разработанная активная масса, является уже приемлемой для создания НЖ-аккумулятора с прессованным железным электродом и по своим характеристикам не уступает активным массам на основе искусственных оксидов железа Создание высокоемкого железного электрода позволяет расширить область применения никель-железных источников тока. Однако это потребует разработки новых типоразмеров никель-железных батарей.
Емкостные характеристики аккумулятора связаны с толщинами положительного и отрицательного электродов и сепаратора. Выбор оптимальных толщин достаточно длительный и трудоемкий процесс, требующий больших материальных затрат. Оптимизация конструкции может быть существенно ускорена при наличии корректной математической модели акуумулятора, прогнозирующей его работу при различных условиях эксплуатации.
Дата добавления: 2015-08-02; просмотров: 48 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| МЕХАНИЗМ ПРОЦЕССОВ НА ОКИСНО-НИКЕЛЕВОМ ЭЛЕКТРОДЕ | | | ФОРМУЛА ИЗОБРЕТЕНИЯ |