
Читайте также:
|
1.Які елементи називаються біогенними елементами?
Біогенні елементи - це такі хімічні елементи, що постійно входять до складу організмів і мають певне біологічне значення. Перш за все це кисень (що становить 70% мас організмів), вуглець (18%), водень (10%), кальцій, азот, калій, фосфор, магній, сірка, хлор, натрій, залізо. Ці елементи входять до складу всіх живих організмів, складають їх основну масу і грають велику роль в процесах життєдіяльності.
2.Які елементи відносяться до органогенів?
Елементи-органогени — хімічні елементи, що становлять основу органічних сполук: карбон, гідроген, оксиген, нітроген, сульфур, фосфор.
3.Який процес називають гідролізом солей?
Гідроліз солей – взаємодія іонів солі з водою, при якій відбувається утворення малодисоційованих сполук, порушується рівновага дисоціації води, і, як правило, змінюється реакція середовища.
4.Які солі підлягають гідролізу?
Гідролізу зазнають солі, утворені:
1.катіоном слабкої основи та аніоном сильної кислоти;
2.катіоном сильної основи та аніоном слабкої кислоти;
3.катіоном слабкої основи та аніоном слабкої кислоти;
5.Якою є кислотність середовища у водному розчині солі, утвореної сильною основою та слабкою кислотою? Відповідь аргументуйте.
Середовище буде лужним, оскільки в цьому випадку концентрація іонів Н⁺ менша за концентрацію іонів ОН⁻.
6.Якою є кислотність середовища у водному розчині солі, утвореної слабкою основою та сильною кислотою? Відповідь аргументувати.
Середовище буде кислим, оскільки в цьому випадку концентрація іонів Н⁺ більша за концентрацію іонів ОН⁻.
7.Якою є кислотність середовища у водному розчині солі, утвореної слабкою основою та слабкою кислотою? Відповідь аргументувати.
Середовище буде нейтральним (або близьким до нейтрального – слабкокислим, слабколужним), оскільки в цьому випадку концентрація іонів Н⁺ та концентрація іонів ОН⁻ рівні.
8.Яка реакція середовища в водному розчині CuCl2? Відповідь аргументувати.
1.CuCl₂- це розчинна сіль, утворена сильною кислотою HCl та слабкою основою Cu(OH)₂ → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
CuCl₂ → Cu²⁺ + 2Cl⁻
З водою буде реагувати катіон Cu²⁺, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
Cu²⁺ + Н₂О ↔ Сu(OH)⁺ + H⁺ - скорочене іонне рівняння
CuCl₂ + H₂O ↔ Cu(OH)Cl + HCl – молекулярне рівняння
Відповідь: Середовище розчину купрум хлориду кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів Н⁺.
9.Яка реакція середовища у водному розчині CH3COONa? Відповідь аргументувати.
1.CH₃COONa – це розчинна сіль, утворена слабкою кислотою CH₃COOН та сильною основою NaOH → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
CH₃COONa → CH₃COO⁻ + Na⁺
З водою буде реагувати аніон CH₃COO⁻, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
CH₃COO⁻ + Н₂О ↔ CH₃COOН + ОН⁻ - скорочене іонне рівняння
CH₃COONa + H₂O ↔ CH₃COOH + Na⁺ + OH⁻ - молекулярне рівняння
Відповідь: Середовище розчину ацетату натрію лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН⁻.
10.Яка реакція середовища у водному розчині Na3PO4? Відповідь аргументувати.
1.Na₃PO₄ - це розчинна сіль, утворена слабкою кислотою H₃PO₄ та сильною основою NaOH → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
Na₃PO₄ → 3Na⁺ + PO₄³⁻
З водою буде реагувати аніон PO₄³⁻, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
PO₄³⁻ + Н₂О ↔ HPO₄ + ОН⁻ - скорочене іонне рівняння
Na₃PO₄ + H₂O ↔ Na₂HPO₄ + NaOH - молекулярне рівняння
Відповідь: Середовище розчину фосфату натрію лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН⁻.
11. Яка реакція середовища у водному розчині ZnSO₄? Відповідь аргументуйте.
1.ZnSO  - це розчинна сіль, утворена сильною кислотою H₂SO₄ та слабкою основою Zn(OH)₂ → дана сіль зазнає гідролізу.
- це розчинна сіль, утворена сильною кислотою H₂SO₄ та слабкою основою Zn(OH)₂ → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
ZnSO  → Zn
→ Zn  + SO₄²⁻
+ SO₄²⁻
З водою буде реагувати катіон Zn  , оскільки саме йому відповідає слабкий електроліт.
, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
Zn  + H₂O ↔ Zn(OH) + H⁺ - скорочене іонне рівняння
+ H₂O ↔ Zn(OH) + H⁺ - скорочене іонне рівняння
ZnSO  + H₂O ↔ Zn(OH) + HSO₄ - молекулярне рівняння
+ H₂O ↔ Zn(OH) + HSO₄ - молекулярне рівняння
Відповідь: Середовище розчину сульфату цинку кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів Н⁺.
12. Яка реакція середовища у водному розчині (CH₃COO)₂Mg? Відповідь аргументуйте.
1.(СН₃СОО)₂Mg - це розчинна сіль, утворена слабкою кислотою CH₃COOН та сильною основою Mg(OH)₂ → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
(СН₃СОО)₂Mg → 2CH₃COO⁻ + Mg²⁺
З водою буде реагувати аніон CH₃COO⁻, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
CH₃COO⁻ + Н₂О ↔ CH₃COOН + ОН⁻ - скорочене іонне рівняння
(СН₃СОО)₂Mg + Н₂О ↔ CH₃COOH + Mg(OH)₂ - молекулярне рівняння
Відповідь: Середовище розчину ацетату магнію лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН⁻.
13. Яка реакція середовища у водному розчині NH₄Cl? Відповідь аргументуйте.
1.NH₄Cl - це розчинна сіль, утворена сильною кислотою HCl та слабкою основою NH₄OH → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
NH₄Cl → NH₄⁺ + Cl⁻
З водою буде реагувати катіон NH₄⁺, оскільки саме йому відповідає слабкий електроліт.
3.Перша стадія гідролізу:
NH₄⁺ + Н₂О ↔ NH₄(ОН) + Н⁺ - скорочене іонне рівняння
NH₄Cl + Н₂О ↔ NH₄(ОН) + HCl – молекулярне рівняння
Відповідь: Середовище розчину хлориду амонію кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів Н⁺.
14. Яка реакція середовища у водному розчині K₂CO₃? Відповідь аргументуйте.
| 1. K₂CO₃ - розчинна сіль, утворена слабкою кислотою Н₂CO₃ та сильною основою KOH → дана сіль зазнає гідролізу. 2. У водному розчині сіль дисоціює на йони: K₂CO₃ → 2К⁺ + CO₃ ²⁻ З водою буде реагувати аніон CO₃ ²⁻, оскільки саме йому віповідає слабкий електроліт. 3. Перша стадія гідролізу: CO₃ ²¯ + Н₂О ↔ НCO₃ ¯ + ОН ¯ - скорочене йонне рівняння K₂CO₃ + Н₂О ↔ КОН + Н₂О + СО₂ - молекулярне рівняння Відповідь: Середовище розчину калій карбонату лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН¯. |
15. Яка реакція середовища у водному розчині Fe(NO₃)₂? Відповідь аргументуйте.
1. Fe(NO₃)₂ - розчинна сіль, утворена сильною кислотою НNO₃ та слабкою основою Fe(OH)₂ → дана сіль зазнає гідролізу.
2. У водному розчині сіль дисоціює на йони:
Fe(NO₃)₂ → Fe² + 2NO₃¯
З водою буде реагувати катіон Fe²⁺, оскільки саме йому відповідає слабкий електроліт.
3. Перша стадія гідролізу:
Fe²⁺ + Н₂О ↔ Fe (OH)₂ + H⁺ - скорочене йонне рівняння
Fe(NO₃)₂ + H₂O ↔ Fe (OH)₂ + HNO₃ - молекулярне рівняння.
Відповідь: Середовище розчину ферум нітрату кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість катіонів Н⁺.
16. Яка реакція середовища у водному розчині AlCl₃? Відповідь аргументуйте.
1.AlCl₃ - розчинна сіль утворена сильною кислотою HCl та слабкою основою Al(OH)₃ → дана сіль зазнає гідролізу
2.У водному розчині сіль дисоціює на іони:
AlCl₃ → Al³⁺ + 3Cl⁻
З водою буде реагувати катіон Al³, оскільки саме йому віповідає слабкий електроліт.
3. Перша стадія гідролізу:
Al³⁺ + H₂O ↔ Al(OH)²⁻ + H⁺ - скорочене іонне рівняння
AlCl₃ + H₂O ↔ AlCl(OH) + HCl – молекулярне рівняння
Відповідь: Середовище розчину хлориду алюмінію кисле, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів Н⁺.
17. Яка реакція середовища у водному розчині Na₂S? Відповідь аргументуйте.
1.Na₂S- розчинна сіль, утворена слабкою кислотою H₂S та сильною основою NaOH → дана сіль зазнає гідролізу.
2.У водному розчині сіль дисоціює на іони:
Na₂S → 2Na⁺ + S²⁻
З водою буде реагувати аніон S ²⁻, оскільки саме йому віповідає слабкий електроліт.
3. Перша стадія гідролізу:
S²⁻ + H₂O ↔ HS⁻ + OH⁻ - скорочене іонне рівняння
Na₂S + H₂O ↔ NaHS + Na(OH) – молекулярне рівняння
Відповідь: Середовище розчину сульфіду натрію лужне, оскільки в результаті гідролізу солі в розчині збільшується кількість іонів ОН⁻.
18.Де краще розчиняється кисень: у воді чи у крові? Відповідь аргументуйте.
Кисень краще розчиняється у воді, оскільки в крові він не розчиняється, а лише зв’язується з гемоглобіном і переноситься по організму. Кров лише приблизно на 70% складається з води і тому відповідно розчинність у цій частині є достатньо великою. А оскільки вода є «чистим продуктом» то в ньому розчинність вища. Але на фактор розчинності можуть вплинути також температура і тиск.
19.За якою формулою можна обчислити молярну концентрацію йонів ОН⁻, якщо відома молярна концентрація йонів Н⁺?
[OH⁻]= 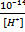
20.Що таке молярна концентрація розчиненої речовини? В яких одиницях вона вимірюється?
Молярна концентрація розчиненої речовини с(х) – відношення кількості речовини компонента n(x) до об’єму розчину V(р-ну):
С(х)=  =
= 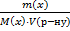
У системі SI молярну концентрацію слід вимірювати в моль/м³, проте у лабораторній практиці молярну концентрацію вимірюють у моль/л.
21.Що таке молярна концентрація еквіваленту розчиненої речовини? В яких одиницях вона вимірюється?
Молярна концентрація еквіваленту розчиненої речовини с  – відношення кількості речовини еквівалента компонента n
– відношення кількості речовини еквівалента компонента n  до об’єму V(р-ну):
до об’єму V(р-ну):
с 
Молярну концентрацію еквіваленту розчиненої речовини вимірюють у моль/л
22.Що таке масова частка розчиненої речовини? В яких одиницях вона вимірюється?
Масова частка розчиненої речовини ω(Х) – відношення маси компонента m(x) до маси розчину m(р-ну):
ω(Х) = 
Масова частка не має розмірності. Масова частка може бути виражена також у відсотках, тоді
ω(Х) =  · 100%
· 100%
23.Що таке масова концентрація розчиненої речовини? В яких одиницях вона вимірюється?
Масова концентрація розчиненої речовини p(x) – відношення маси компонента m(x) до об’єму розчину V(р-ну):
р(х) = 
Масову концентрацію вимірюють у кг/м³. Допускається також г/м³; г/л; г/см³; мг/л; мг/см³ тощо
24.Який зв'язок між молярною концентрацією розчиненої речовини та молярною концентрацією еквівалента розчиненої речовини?
c  = c
= c 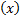 · z
· z
Прямопропорційна залежність: чим більша молярна концентрація розчиненої речовини тим більша молярна концентрація еквівалента розчиненої речовини.
25. Який зв'язок між молярною концентрацією розчиненої речовини та масовою концентрацією розчиненої речовини?
p 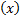 = c
= c  · M
· M 
Прямопропорційна залежність: чим більша молярна концентрація розчиненої речовини тим більша масова концентрація розчиненої речовини.
26.Який зв'язок між масовою часткою розчиненої речовини та масовою концентрацією розчиненої речовини?
m(р-ну) · w( ) = p(
) = p( ) · V(р-ну)
) · V(р-ну)
Прямопропорційна залежність: чим більша масова частка розчиненої речовини, тим більша масова концентрація розчиненої речовини.
27.Як приготувати 200г спиртового розчину йоду з масовою часткою йоду 5%?
Дано: 1) m(I) = 200 · 0,05 = 10 г
m(р-ну) =200 г 2) m(спирту) = 200 – 10 = 190 г
ω(I)=5%
m(I)-?
m(спирту)-?
Відповідь: Потрібно змішати 190 г спирту з 10 г йоду.
28.Як приготувати 300г спиртового розчину йоду з масовою часткою йоду 5%?
Дано: 1) m(I) = 300 · 0,05 = 15 г
m(р-ну) =300 г 2) m(спирту) = 300 – 15 = 285г
ω(I)=5%
m(I)-?
m(спирту)-?
Відповідь: Потрібно змішати 285 г спирту з 15 г йоду.
29.Як приготувати 1000г фізіологічного розчину NaCl(масова частка NaCl дорівнює 0,9%)?
Дано: 1) m(NaCl) = 1000 · 0,009 = 9 г
m(р-ну) =1000 г 2) m(Н₂О) = 1000 – 9 = 991 г
ω(NaCl)=0,9%
m(NaCl)-?
m(H₂O)-?
Відповідь: Потрібно змішати 9 г хлориду натрію і 991 г води.
30.В чому полягає принципова відмінність комплексних сполук від інших? Навести приклади комплексних сполук.
Комплексні сполуки – хімічні сполуки, кристалічні решітки яких складаються з комплексних груп, утворених внаслідок взаємодії іонів або молекул, здатних існувати самостійно. І їх утворення з більш простих сполук не пов’язане з виникненням нових електронних пар.
K₄[Fe(CN)₆]; [Zn(NH₃)₄(OH)₂]; [Pt(NH₃)₂Cl₂];
31.Які комплекси називають катіонними? Навести два приклади.
Катіонні комплекси – це ті комплекси, внутрішні сфери яких, мають позитивний заряд.
[Co³⁺(NH₃⁰)₆]³⁺Cl₃⁻; [Cu²⁺(NH₃⁰)₂H₂O⁰Cl⁻]⁺NO₃⁻;
32.Які комплекси називають аніонними? Навести два приклади.
Аніонні комплекси – це ті комплекси, внутрішні сфери яких, мають негативний заряд.
K⁺[Ag⁺(CN)⁻₂]⁻; Cu²⁺[Pt⁺⁴Cl⁻(OH)⁻₅]²⁻;
33.Які комплекси називають нейтральними? Навести два приклади.
Нейтральні комплекси – це ті комплекси, які не мають зовнішньої сфери, а заряд внутрішньої сфери відповідно 0.
[Pt²⁺(NH₃⁰)₂Cl₂⁻]; [Co³⁺(NH₃⁰)₃(NO₂)⁻₃]
34.Які комплекси називають аквакомплексами? Навести приклад.
Аквакомплекси – це ті комплекси, лігандами яких є вода. [Al(H₂O)₆]Cl₃
35.Які комплекси називають ацидокомплексами? Навести приклад.
Ацидокомплекси – це ті комплекси, для яких лігандами є кислотні залишки. K[Ag(CN)₂]
36.Які комплекси називають амінокомплексами? Навести приклад.
Амінокомплекси – це ті комплекси, лігандами яких є молекули NH₃, або молекули, що містять групи: NH₂, NH, або N. [Cr(CH₃NH₂)₆](NO₃)₃
37.Що таке комплексоутворювач? Що таке ліганди? Що таке координаційне число?
Комплексоутворювач – це центральний атом або центральний іон. Типовими комплексоутворювачами є Cr, Co, Ni, Fe, Mn, Ag⁺, Au⁺, Cu⁺, Cu²⁺, Hg²⁺, Cd²⁺, Zn²⁺, Fe²⁺, Co²⁺, Ni²⁺, Pt²⁺, Cr³⁺, Fe³⁺, Pt⁴⁺
Ліганди – молекули неорганічних і органічних сполук Н₂О, NH₃, OH⁻, CN⁻,Cl⁻, F⁻ тощо, які за рахунок неподільних електронних пар утворюють ковалентні зв’язки з комплексоутворювачем за донорно-акцепторним механізмом.
Кординаційне число – кількість ᵟ зв’язків, які утворює центральний атом з лігандами.
38.Чому дорівнює ступінь окиснення феруму в гемі гемоглобіну?
2+
39.Чому дорівнює координаційне число в гемі гемоглобіну?
40.Чим відрізняється будова молекули гемоглобіну від будови молекули оксигемоглобіну?
Оксигемоглобін це гемоглобін, який приєднав кисень.
41.Чим відрізняється будова молекули гемоглобіну від будови карбоксигемоглобіну?
Карбоксигемоглобін це гемоглобін до якого приєднався вуглекислий газ.
42.Який йон є комплексоутворювачем в інсуліні?
Zn²⁺
43. Який йон є комплексоутворювачем у вітаміні В₁₂?
Co²⁺
44. Який йон є комплексоутворювачем у хлорофілі?
Mg²⁺
45.Що таке хелати? Що таке хелатотерапія?
Хелати - клішнеподібні комплексні сполуки, що утворюються при взаємодії іонів металів з молекулами деяких органічних сполук, що містять солеутворюючу і комплексоутворюючу групи. Хелатні сполуки містять центральний іон (частинку) — комплексоутворювач — і координовані навколо нього ліганди. Хелатні сполуки часто використовуються в хімії для розділення, концентрації і визначення різних елементів.
Хелатотерапія - це виведення токсичних часток з організму, засноване на хелатируванні їх комплексонатами s-елементів.
46.Що таке водневий показник? За якою формулою його обчислюють?
Водневий показник(рН) – кількісна характеристика кислотності середовища, що дорівнює від’ємному десятковому логарифму активної концентрації вільних іонів гідрогену в розчині.
рН = - lg[H⁺]
47.Що таке йонний добуток води? Чому він дорівнює при кімнатній температурі?
Йонний добуток води(К(Н₂О)) – добуток рівноважних молярних концентрацій іонів Н⁺ і ОН⁻ і є сталою величиною.
К(Н₂О) = [Н⁺] · [ОН⁻] = 10⁻¹⁴ 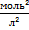 (залежить лише від температури)
(залежить лише від температури)
48.Чому дорівнює рН артеріальної крові? рН венозної крові?
рН артеріальної крові = 7,37-7,43; рН венозної крові = 7,34
49.Що таке ацидоз? алкалоз?
Ацидоз - підвищена кислотність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги.рН↓
Алкалоз – підвищена основність крові, шлункового соку та тканин організму внаслідок зміни кислотно-лужної рівноваги. рН↑
50.Що таке процес титрування?
Титрування – процес поступового додавання робочого розчину до проби з метою встановлення точного об’єму розчину титранту, витраченого на реакцію з аналітом.
51.Що таке аналіт? Робочий розчин?
Робочий розчин(титрований, стандартний) – розчин реагенту, молярна концентрація еквіваленту якого встановлена з великою точністю.
Аналіт – розчин, в якому визначають молярну концентрацію еквівалента речовини, називають пробою.
52.Який закон лежить в основі титриметричних розрахунків? Навести математичний вираз цього закону.
Обчислення в об’ємному аналізі ґрунтуються на законі еквівалентів: «Маси речовин, що вступили в реакцію, пропорційні молярним масам еквівалентів цих речовин»

53.Яка реакція лежить в основі методу кислотно-основного титрування?
H⁺+OH⁻=H₂O
54.Які робочі розчини використовують в методі кислотно-основного титрування?
Розчини сильних кислот H₂SO₄, HCl та лугів NaOH, KOH. Вихідними речовинами для сильних кислот є: Na₂B₄O₇ · 10H₂O; Na₂CO₃; для лугів: H₂C₂O₄ · 2H₂O
55.Що таке точка еквівалентності?
Точка еквівалентності – момент (стан), при титруванні, коли кількість речовини доданого титрованого розчину хімічно еквівалентна кількості речовини, що титрується.
56.Як визначають точку еквівалентності?
У цей момент змінюється забарвлення або утворюється осад. Якщо вихідні речовини безбарвні то застосовують індикатор. У цей момент без додаткових специфічних умов можна помітити ці зміни.
57.Що таке кислотно-основні індикатори?
Кислотно-основні індикатори – це індикатори, які використовують у методі нейтралізації, і є органічними речовинами, що мають властивості слабких кислот або основ, у яких недиссоційовані молекули та іони, що утворюються при дисоціації цих молекул, мають різне забарвлення.
58.Що таке інтервал переходу індикатору?
Інтервал переходу індикатора – проміжок рН, в якому стає помітною для очей зміна забарвлення індикатора
59.Чому дорівнює інтервал переходу фенолфталеїну? Метилового червоного?
Інтервал переходу фенолфталеїну - рН 8,2-9,8; інтервал переходу метилового червоного рН 4,2-6,2;
60.Чому приблизно дорівнює інтервал переходу індикатору?
рН = рК ± 1, а середина інтервалу рН=рК
61.Що таке крива титрування?
Крива титрування – графічне зображення зміни рН розчину в процесі його титрування.
62.Що таке стрибок титрування?
Стрибок титрування – різка зміна рН розчину, що спостерігається поблизу точки еквівалентності, тобто в кінці титрування.
63.Як за допомогою кривої титрування підбирають індикатор?
Обирають індикатор за допомогою кривої титрування. Для цього на графік кривої титрування наносять інтервал переходу індикатора. У правильно обраного індикатора інтервал переходу повністю або частково перекривається стрибком титрування. Якщо такого перекривання немає, індикатор для даного титрування не підходить.
64.За якою формулою можна розрахувати молярну концентрацію еквівалента аналіту?
с 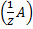 =
= 
65.За якою формулою можна розрахувати масу аналіту?
m(A)=  · Vзаг.(A)
· Vзаг.(A)
Якщо Vзаг.(A)=Vпроби(A): m(A)=  ·
· 
66.Який робочий розчин необхідно взяти для титрування розчину NaOH? За якою формулою можна розрахувати масу NaOH за результатами титрування?
NaOH + HCl → NaCl + H₂O
m(NaOH)=c(HCl) ·V(HCl) · M(NaOH)
67.Який робочий розчин необхідно взяти для титрування розчину NaOH? За якою формулою можна розрахувати молярну концентрацію еквіваленту NaOH за даними титрування?
NaOH + HCl → NaCl + H₂O
c(NaOH) = 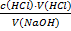
68.Який робочий розчин необхідно взяти для титрування розчину КOH за результатами титрування? За якою формулою можна розрахувати масу КOH за результатами титрування?
KOH + HCl → KCl + H₂O
m(KOH)=c(HCl) ·V(HCl) · M(KOH)
69.Який робочий розчин необхідно взяти для титрування розчину КOH? За якою формулою можна розрахувати молярну концентрацію еквіваленту КOH за даними титрування?
KOH + HCl → KCl + H₂O
c(KOH) = 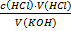
70.Який робочий розчин необхідно взяти для титрування водного розчину NH₃? За якою формулою можна розрахувати масу NH₃ за результатами титрування?
NH₃ + HCl → NH₄Cl
m(NH₃)=c(HCl) ·V(HCl) · M(NH₃)
71.Який робочий розчин необхідно взяти для титрування водного розчину NH₃? За якою формулою можна розрахувати молярну концентрацію еквіваленту NH₃ за даними титрування?
NH₃ + HCl → NH₄Cl
c(NH₃) = 
72.Який робочий розчин необхідно взяти для титрування розчину HCl? За якою формулою можна розрахувати масу HCl за результатами титрування?
HCl + KOH → KCl + H₂O
m(HCl)=c(KOH) ·V(KOH) · M(HCl)
73.Який робочий розчин необхідно взяти для титрування розчину HCl?За якою формулою можна обчислити молярну концентрацію еквіваленту HCl за даними титрування?
HCl + KOH → KCl + H₂O
c(HCl) = 
74.Який робочий розчин необхідно взяти для титрування розчину H₂SO₄? За якою формулою можна розрахувати масу H₂SO₄ за результатами титрування?
H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
m(H₂SO₄)= 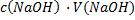 ·
· 
75.Який робочий розчин необхідно взяти для титрування розчину H₂SO₄? За якою формулою можна розрахувати молярну концентрацію еквіваленту H₂SO₄ за даними титрування?
H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O
с  =
= 
76.Який робочий розчин необхідно взяти для титрування розчину CH₃COOH? За якою формулою можна розрахувати масу CH₃COOH за результатами титрування?
CH₃COOH + NaOH → CH₃COONa + H₂O
m(CH₃COOH)= 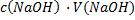 ·
· 
77.Який робочий розчин необхідно взяти для титрування розчину CH₃COOH? За якою формулою можна розрахувати молярну концентрацію еквівалента CH₃COOH за даними титрування?
CH₃COOH + NaOH → CH₃COONa + H₂O
c(CH₃COOH) = 
78.Що таке буферна система (буфер)?
Буферна система – розчини, які мають властивість зберігати сталість рН при розведенні і протидіяти зміні рН при додаванні помірних кількостей сильної кислоти або лугу.
79.З яких компонентів складається кислотний буфер? Навести приклад кислотного буферу.
Кислотний буферний розчин містить слабку кислоту та сіль, утворену цією кислотою і сильною основою.
Н₂СО₃, Na₂CO₃;
80.З яких компонентів складається основний буфер? Навести приклад основного буферу.
Основний буферний розчин містить слабку основу та сіль, утворену цією основою та сильною кислотою.
NH₃ · H₂O, NH₄Cl;
81.Від чого залежить рН буферу?
Значення рН залежить від величини константи дисоціації слабкої кислоти(основи) та співвідношення концентрацій солі і кислоти(основи).
32.Написати рівняння Гендерсона-Гассельбаха для рН кислотного буферу?
pH = pKd + lg 
83. Написати рівняння Гендерсона-Гассельбаха для рН основного буферу?
pH = 14 – [ pKd + lg  ]
]
84.Що таке буферна ємність?
Буферна ємність – кількість молей еквіваленту сильної кислоти або сильної основи, яку потрібно додати до одного літра буферного розчину, щоб змінити його рН на одиницю.
85.За яких умов буфер має максимальну ємність?
Найбільша величина буферної ємності досягається, якщо компоненти буферної суміші мають однакові концентрації, тоді рН=рК
86.З яких компонентів складається фосфатний буфер?
Na₂HPO₄, NaH₂PO₄;
87.З яких компонентів складається ацетатний буфер?
CH₃COONa, CH₃COOH;
88.З яких компонентів складається амонійний буфер?
NH₃ · H₂O, NH₄Cl;
89.З яких компонентів складається гідрокарбонатний буфер?
Н₂СО₃, Na₂CO₃;
90.Які буферні системи підтримують рН крові?
Гемоглобінова, бікарбонатна, фосфатна, білкова буферні системи підтримують рН крові.
91.Який з компонентів фосфатного буферу вступає в реакцію при додаванні НСl?
NaH₂PO₄ → H₂PO₄⁻ + Na⁺
Na₂HPO₄ → 2Na⁺ + HPO₄²⁻
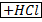
HCl → H⁺ + Cl⁻
Na₂HPO₄ + HCl → NaH₂PO₄ + NaCl
HPO₄²⁻ + H⁺ → H₂PO₄
92.Який з компонентів ацетатного буферу вступає в реакцію при додаванні НСl?
CH₃COOH ↔ CH₃COO⁻ + H⁺
CH₃COONa ↔CH₃COO⁻ + Na⁺
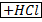
HCl → H⁺ + Cl⁻
CH₃COONa + HCl = CH₃COOH + NaCl
CH₃COO⁻ + H⁺ = CH₃COOH
93.Який з компонентів амонійного буферу вступає в реакцію при додаванні НСl?
NH₃ · H₂O ↔ NH₄⁺ + OH⁻
NH₄Cl → NH₄⁺ + Cl⁻
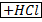
HCl → H⁺ + Cl⁻
NH₃ · H₂O + HCl = NH₄Cl + H₂O
NH₃ · H₂O + H⁺ ↔ NH₄⁺ + H₂O
94.Який з компонентів гідрокарбонатного буферу вступає в реакцію при додаванні НСl?
CO₂ · H₂O ↔ H⁺ + HCO₃⁻
NaHCO₃ → Na⁺ + HCO₃⁻
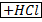
HCl → H⁺ + Cl⁻
NaHCO₃ + HCl = NaCl + CO₂ + H₂O
HCO₃⁻ + H⁺ = CO₂ + H₂O
95.Який з компонентів фосфатного буферу вступає в реакцію при додаванні NaOH?
NaH₂PO₄ → H₂PO₄⁻ + Na⁺
Na₂HPO₄ → 2Na⁺ + HPO₄²⁻
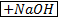
NaOH → Na⁺ + OH⁻
NaH₂PO₄ + NaOH = Na₂HPO₄ + H₂O
H₂PO₄⁻ + OH⁻ = HPO₄²⁻ + H₂O
96.Який з компонентів ацетатного буферу вступає в реакцію при додаванні NaOH?
CH₃COOH ↔ CH₃COO⁻ + H⁺
CH₃COONa ↔CH₃COO⁻ + Na⁺
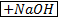
NaOH → Na⁺ + OH⁻
CH₃COOH + NaOH = CH₃COONa + H₂O
CH₃COOH + OH⁻ = CH₃COO⁻ + H₂O
97.Який з компонентів амонійного буферу вступає в реакцію при додаванні NaOH?
NH₃ · H₂O ↔ NH₄⁺ + OH⁻
NH₄Cl → NH₄⁺ + Cl⁻
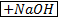
NaOH → Na⁺ + OH⁻
NH₄Cl + NaOH = NH₃ ·H₂O + NaCl
NH₄⁺ + OH⁻ = NH₃ ·H₂O
98.Який з компонентів гідрокарбонатного буферу вступає в реакцію при додаванні NaOH?
CO₂ · H₂O ↔ H⁺ + HCO₃⁻
NaHCO₃ → Na⁺ + HCO₃⁻
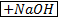
NaOH → Na⁺ + OH⁻
CO₂ · H₂O + NaOH = NaHCO₃ + H₂O
CO₂ · H₂O +H⁺ = HCO₃⁻ + H₂O
99.Які властивості розчинів називаються колігативними?
Колігативними називаються властивості розчинів, що залежать від числа кінетичних одиниць системи(молекул чи іонів). До них відносять зниження пружності насиченої пари розчинника над розчином, підвищення температури кипіння, зниження температури замерзання розчинів, дифузію, осмос та деякі інші властивості.
100.Що таке осмос?
Осмос – це явище, коли 2 розчини різної концентрації, або розчин і розчинник відділені один від одного напівпроникною мембранною перегородкою, яка вільно пропускає молекули розчинника і не пропускає молекули розчиненої речовини. Фактично це напівдифузія молекул розчинника із тієї частини, де його більше в ту частину де його менше.
101.За яким рівнянням розраховують осмотичний тиск розчину?
π = 
π =  – для електролітів
– для електролітів
102.Які розчини називають ізотонічними?
Ізотонічні розчини – розчини, які мають однаковий осмотичний тиск.
103.Назвіть розчин ізотонічний по відношенню до крові?
Фізіологічний розчин(0,9% водний розчин хлориду натрію)
104.Чому дорівнює осмотичний тиск крові?
π крові =7,6 – 7,7 атм
105.Що таке онкотичний тиск крові?
Онкотичний тиск крові – це частина осмотичного тиску, що створюється білками. В утворенні онкотичного тиску найбільшу роль відіграють низькомолекулярні білки альбуміни – саме від їх вмісту в плазмі залежить, перш за все, рОНкрові. Його нормальна величина складає 25-30 мм рт.ст.
106.Чи будуть ізотонічними водні розчини сахарози та сечовини з однаковою молярною концентрацією розчиненої речовини? Відповідь аргументувати.
107.Який розчин називають гіпертонічним?
Гіпертонічний розчин - це розчин, осмотичний тиск якого вище нормального осмотичного тиску плазми крові або осмотичного тиску в рослинних або тваринних клітинах і тканинах.
108.Який розчин називають гіпотонічним?
Гіпотонічний розчин - це розчин, осмотичний тиск якого нижчий, ніж у плазмі крові, або у клітинах тваринних та рослинних організмів.
109.Яке явище називають гемолізом?
Гемоліз – руйнування еритроцитів крові шляхом розриву їх оболонок з виділенням в навколишнє середовище гемоглобіну.
110.Яке явище називають плазмолізом?
Плазмоліз - відділення протопласту від клітинної стінки при зануренні клітини в гіпертонічний розчин.
111.Що буде спостерігатися(гемоліз чи плазмоліз), якщо еритроцити помістити в гіпертонічний розчин?
Буде спостерігатись явище плазмолізу.
112. Що буде спостерігатися(гемоліз чи плазмоліз), якщо еритроцити помістити в гіпотонічний розчин?
Буде спостерігатись явище гемолізу.
113.Що таке ізотонічний коефіцієнт?
Ізотонічний коефіцієнт – це відношення загального числа частинок(молекул та іонів) розчиненої речовини в розчині до вихідного числа молекул речовини, враховує міжмолекулярні взаємодії в реальних розчинах.
114.Чи будуть ізотонічними водні розчини глюкози та NaCl з однаковою молекулярною концентрацією розчиненої речовини?Відповідь аргументувати.
115. Чи будуть ізотонічними водні розчини CaCl₂ та NaCl з однаковою молекулярною концентрацією розчиненої речовини?Відповідь аргументувати.
116.Чи буде однаковою температура кипіння водних розчинів сахарози та сечовини з однаковою моляльністю? Відповідь аргументувати.
117. Чи буде однаковою температура кипіння водних розчинів сахарози та сечовини в етанолі, якщо їх моляльність однакова? Відповідь аргументувати.
118.Чи буде однаковою температура замерзання водних розчинів глюкози та KCl з однаковою моляльністю? Відповідь аргументувати.
119.Чи буде однаковою температура замерзання водних розчинів глюкози та сечовини з однаковою моляльністю? Відповідь аргументувати.
120.Чи буде однаковою температура замерзання водних розчинів CaCl₂ та NaCl та сечовини з однаковою моляльністю? Відповідь аргументувати.
Дата добавления: 2015-08-02; просмотров: 238 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Почему сгорает масло и как с этим бороться? | | | НЕРАБОТАЮЩИЕ ЛЮДИ, НАЙДИТЕ ПО ВОЗМОЖНОСТИ ВРЕМЯ ПРИЙТИ В ПАРК В РАБОЧИЕ ЧАСЫ ПО БУДНИМ ДНЯМ. |