
|
Читайте также: |
В основе перманганатометрического титрования лежит окислительно-восстановительный процесс с участием редокс-пары MnO4– /Mn2+. Реакцию, как правило, проводят в кислой среде, так как в результате реакции образуются почти бесцветные ионы Mn2+:
MnO4– + 8H+ + 5ē D Mn2+ + 4H2O
При окислении в нейтральной или щелочной среде выпадает темно-бурый осадок MnO2, сильно затрудняющий фиксирование точки эквивалентности. Кроме того, окислительная способность перманганата калия в кислой среде гораздо выше (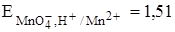 B), чем в щелочной (
B), чем в щелочной (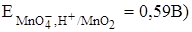 , и количество титруемых им восстановителей в первом случае значительно больше, чем во втором.
, и количество титруемых им восстановителей в первом случае значительно больше, чем во втором. 
В зависимости от рН среды f экв(MnO4–) может принимать различные значения. При окислении в кислой среде f экв(MnO4–) =  . При окислении в нейтральной среде протекает следующая реакция:
. При окислении в нейтральной среде протекает следующая реакция:
MnO4– + 8H+ + 3ē D MnО2↓ + 2H2O; f экв(MnO4–) = 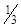
При окислении в щелочной среде
MnO4– + ē D MnO42–; f экв(MnO4–) = 1.
Рабочие растворы метода:
ü КMnO4;
ü H2C2O4 и оксалаты;
ü растворы других восстановителей (соли Fe2+ и др.).
Вспомогательные растворы метода:
H2SO4 – для создания сильнокислой среды;
смесь Рейнгарда – Циммермана – для титрования в присутствии хлорид-ионов.
Для перманганатометрических определений рекомендуется применять 0,05 н. раствор КMnO4. Конечную точку титрования определяют без индикатора по появлению собственной фиолетовой окраски перманганат-иона.
Дата добавления: 2015-08-10; просмотров: 56 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Построение кривых титрования и подбор индикаторов. | | | Иодометрия |