
|
Читайте также: |
Широко распространены также и тривиальные, исторически сложившиеся наименования:

Ниже представлен гомологический ряд дикарбоновых (диовых) кислот:

Реже встречается способ наименования с использованием обозначения положения заместителей буквами греческого алфавита. Обозначение начинается с атома углерода, соседнего с карбоксильной группой:

II. Физические свойства простейших представителей насыщенных карбоновых кислот.
Физические свойства карбоновых кислот:
1)не существуют в газообразном виде;
2) С1-С9 - жидкие вещества (жидкое состояние кислот обусловлено образованием межмолекулярных водородных связей);
3) высшие кислоты (от С10) - твердые вещества
4) с характерным резким запахом;
5) имеют высокие температуры плавления и кипения; с повышением относительной молекулярной массы температуры кипения и плавления повышаются;
6) хорошо растворимы в воде; с повышением относительной молекулярной массы растворимость кислот в воде уменьшается;
7) с увеличением углеводородного радикала сила кислот уменьшается.
Детальнее рассмотрим физические свойства простейших представителей насыщенных карбоновых кислот.
Муравьиная кислота (метановая кислота) НСООН, молярная масса равна 46,03; бесцветная жидкость с резким запахом; tпл = 8,4°С, tкип = 100,7°С; смешивается во всех соотношениях с водой, диэтиловым эфиром, этанолом, умеренно растворима в бензоле, толуоле, ССl4.
Муравьиная кислота - простейшая карбоновая кислота, заметно сильнее других кислот. Вступает в реакции окисления - восстановления, присоединения, циклизации.
Уксусная кислота (этановая кислота) CH3COOH, молярная масса равна 60,05; бесцветная прозрачная жидкость с резким раздражающим запахом. Для безводной ("ледяной") tпл = 16,64 0C, tкип = 117,8 0C. Смешивается со многими растворителями, хорошо растворяет органические соединения, в ней растворяются газы HF, HCl, HBr, HI и др.
III. Химические свойства насыщенных карбоновых кислот.
1) сложная карбоксильная группа является сочетанием карбонильной и гидроксильной групп. Последняя под влиянием карбонильной группы существенно отличается от гидроксильной группы спиртов, и входящий в нее кислород в водных растворах отщепляется в виде катиона; карбоновые кислоты подвергаются электролитической диссоциации:
RCOOH = RCOO- + H+.
Пример:

2) сила большинства карбоновых кислот достаточна, чтобы вытеснить угольную кислоту из ее солей:

В свою очередь угольная кислота распадается на воду и углекислый газ.
Карбоновые кислоты не реагируют с солями более сильных кислот - фосфорной, соляной серной и т.д.
3) получение ангидридов кислот.
Ангидриды кислот можно рассматривать как продукты дегидратации двух молекул кислоты. При отнятии воды от карбоновых кислот (которое удается осуществить только при помощи фосфорного ангидрида Р2О5) можно получать смешанные и моноангидриды:

Другой способ получения ангидридов - реакция солей карбоновых кислот с галогенангидридами кислот:

Уксусный ангидрид - жидкость, кипящая при 140 оС, обладающая неприятным резким запахом. Ангидрида муравьиной кислоты не существует.
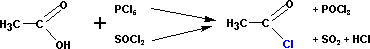
4) получение галогенангидридов кислот.
Хлорангидриды кислот получают классическими реакциями замены гидроксильной группы на галоген (так же, как и в случае со спиртами):
5) получение сложных эфиров.
Этерификация кислот спиртами приводит к сложным эфирам с переменным успехом. Реакция протекает в кислой среде и обратима. Роль кислоты заключается в активации (усилении реакционной способности) карбоновой кислоты (но не спирта!) путем протонирования:
 Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
Протонированная по атому кислорода карбонильной группы кислота атакуется атомом кислорода спирта (на нем имеются две неподеленные пары электронов):
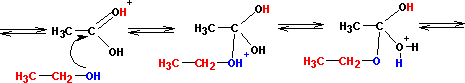
Реакция завершается переносом протона, отщеплением воды и, наконец, отщеплением самого протона (регенерация катализатора):

Пример:
Муравьиная кислота взаимодействует с этиловым спиртом. Образуется этиловый эфир муравьиной кислоты или этилформиат.
НСООН + С2Н5ОН = Н-С + Н2О
С2Н5
Уксусная кислота реагирует с фенолом. В результате образуется фениловый эфир уксусной кислоты или фенил ацетат.
СН3СООН + = СН3-С +Н2О
6) важное химическое свойство карбоновых кислот - способность превращаться в производные. При взаимодействии с металлами, оксидами, основаниями карбоновые кислоты дают соли:
НСООН + Mg = (НСОО)2 Mg + Н2 (газ.)
СН3СООН + СаО = (СН3СОО)2Са + Н2О
СН3СООН + NaOH = CH3COONa + H2O
7) реакции декарбоксилирования (общая схема):

Реакция взаимодействия ацетата натрия с NaOH протекает при сплавлении:

8) пиролиз карбоновых кислот и их солей:

9)При нагревании муравьиная кислота разлагается с образованием СО2 и Н2; H2SO4 расщепляет ее на СО и Н2О; Н2О2 окисляет до надмуравьиной кислоты НСОООН.
IV. получение карбоновых кислот.
1. Каталитическое окисление ацетатальдегида в жидкой фазе в присутствии солей Mn или смеси солей Mn, Со, Ni и Fe при 56-75 0С и давлении 0,2-0,3 МПа; окислитель - технический O2, выход уксусной кислоты составляет 92-93%.
2. Жидкофазное окисление воздухом углеводородных фракций нефти C5-C6 при 140-180 0C и давлении 5-8 МПа; наряду с уксусной кислотой получают муравьиную (15% по массе от суммы продуктов) и пропионовую кислоты (7-8%).
3. Уксуснокислое брожение спиртовых жидкостей (пищевая уксусная кислота).
4. Пиролиз древесины (наряду с метанолом и ацетоном). В лаборатории безводную уксусную кислоту получают перегонкой сухого CH3COONa и H2SO4.
Промышленные способы:
1. Окисление первичных спиртов последовательно приводит к карбоновым кислотам:


в) окисление алканов:

Лабораторные способы получения карбоновых кислот:
1) окисление спиртов, алкенов, алкинов, альдегидов KMnO4, K2Cr2O7, H2O2 и другими окислителями;
2) гидролиз:

хлорангидрид уксусной кислоты
V. Применение карбоновых кислот. Их значение в жизни человека.
Карбоновые кислоты, их производные, имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид - в производстве ацетилцеллюлозы. Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n-аминосалициловую кислоту и др.
Высшие жирные карбоновые кислоты широко применяют как сырьё для производства мыла, лаков и красок, поверхностно-активных веществ, в производстве каучуков, резин и др. Адипиновая кислота - один из исходных продуктов в производстве полиамидного волокна (нейлона), терефталевая - в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло.
Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители.
В природе уксусная кислота распространена в свободном виде или в виде солей и сложных эфиров в растениях (в зеленых листьях), в выделениях животных (моче, желчи), образуется при гниении и брожении (в кислом молоке, сыре, вине). Брожение происходит под влиянием специфических бактерий "уксусного грибка". Уксусную кислоту применяют в пищевой промышленности, для получения лекарственных и душистых веществ, хлоруксусных кислот, как растворитель.
Муравьиную кислоту применяют как протраву при крашении и отделке текстиля и бумаги, обработке кожи; как консервант при силосовании зеленой массы, фруктовых соков, а также для дезинфекции бочек для пива и вина; для получения лек. средств, пестицидов, растворителей (например, диметилформамида), солей и эфиров. Метилформиат - растворитель жиров, и растительных масел, целлюлозы, жирных кислот. Этил-формиат - отдушка для мыла; применяют в производстве витаминов B1, A, E. Бензилформиат - растворитель лаков, красителей, душистых веществ.
Дата добавления: 2015-07-20; просмотров: 206 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| А) номенклатура IUPAC. | | | Реферат |