
|
Читайте также: |
Майкл Розенблатт (Michael Rosenblatt)
Эндогенные опиатные пептиды — энкефалины и эндорфины — присутствуют в гипоталамусе и в головном мозге, в эндокринных железах (гипофизе, надпочечниках, яичниках и семенниках) и в пищеварительном тракте (включая поджелудочную железу). Эти пептиды составляют класс, состоящий приблизительно из 10—15 веществ, молекула каждого из которых включает в себя от 5 до 31 аминокислоты. Некоторые из них делят общие пути биосинтеза и секреции с такими гормонами, как адренокортикотропный (АКТГ), а-меланоцитостимулирующий (a-МСГ), b-меланоцитостимулирующий (b-МСГ) и b-липотропный (b-ЛПГ). Они обладают: 1 — морфиноподобным анальгезирующим действием; 2 — влиянием на поведенческие реакции; 3 — способностью функционировать в качестве нейромедиаторов и нейромодуляторов. Действительно, эти пептиды могут играть определенную роль в осуществлении многих функций, таких как память, способность к облучению, реакция на стресс, размножение, передача болевых импульсов и регуляция аппетита, температуры тела и дыхания (табл. 69-1). Кроме того, с действием энкефалинов и эндорфинов могут быть связаны реакция на плацебо, обезболивание посредством акупунктуры, индуцированная стрессом аменорея и патогенез шока. Во взаимосвязи с эндорфинами могут находиться и такие феномены, как седативное действие, раздражительность, возбуждение, буйное поведение, каталепсия, нарколепсия и кататония. Другие поведенческие феномены, такие как привычка к курению, алкоголизм, наркомания, могут отражать биохимические нарушения в этой системе.
Таблица 69 1. Биологические эффекты и возможная роль эндогенных опиатов в различных физиологических феноменах
Обезболивание
Состояние, подобное кататонии
Судорожные припадки
Регуляция температуры тела
Контроль за аппетитом функция размножения (эндокринная)
Сексуальное поведение
Снижение артериального давления
Реакция на стресс
Высвобождение гормонов гипоталамуса/гипофиза
Изменение памяти
Регуляция дыхания
Модулирование иммунного ответа
Изучение энкефалинов и эндорфинов началось с обнаружения опиатных рецепторов, которые были выявлены и охарактеризованы до того, как были выделены первые эндогенные опиатные пептиды. Существование рецепторов, связывающих алкалоиды опиума, такие как морфин, в центральной нервной системе и других тканях вызвало к жизни телеологический вопрос о причине их существования. Кажется невероятным, чтобы эти рецепторы существовали для обеспечения взаимодействия с экзогенно вводимыми лекарственными средствами; было постулировано существование эндогенных веществ с морфиноподобными свойствами и были предприняты усилия для их выявления.
В 1975 г. Hughes и Kosteriitz с соавт. опубликовали сообщение об открытии ими двух небольших (молекулы состоят из 5 аминокислот) пептидов головного мозга, которые связываются с опиатными рецепторами и являются более сильнодействующими веществами, чем морфин. Они назвали эти вещества энкефалинами (что означает «в голове»). Через несколько месяцев из гипоталамо-гипофизарных экстрактов было выделено еще три опиатных пептида, размер молекулы которых был больше, чем у молекул энкефалинов, и их назвали эндорфинами (сокращение от слов «эндогенный морфин»). Позднее к этому списку были добавлены динорфин, a-неоэндорфин и другие вещества. Термин «эндорфин» используется некоторыми авторами в качестве общего названия всех опиатных пептидов.
Строение и биосинтез. Строение некоторых эндогенных опиатов показано на рис. 69-1. Хотя эти вещества химически не родственны морфину, исследования с моделированием соответствующих молекул показывают, что молекула морфина может принимать форму, сходную с гипотетической формой молекул энкефалинов и эндорфинов, которую они могут приобретать в момент их взаимодействия с рецептором.
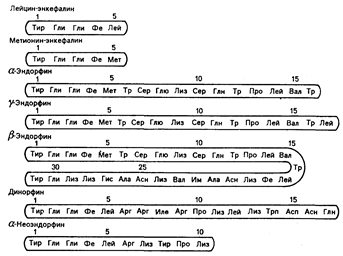
Рис. 69-1. Строение некоторых эндогенных опиатных пептидов.
Четыре аминокислоты, составляющие аминоокончание (слева), одинаковы в каждом пептиде. В положении 5 обнаруживают метионин или лейцин.
По своему строению эти вещества идентичны друг другу по четырем аминокислотам в их аминоокончаниях, которые представляют собой «активный центр» молекулы, хотя каждое из этих веществ обладает различным биологическим действием. Эндорфины как класс лучше связываются с опиатными рецепторами, чем сам морфин, и они проявляют себя в 20—700 раз более сильнодействующими, чем алкалоиды морфина, в различных исследованиях их биологической активности, проводимых как in vitro, так и in vivo. В ряде случаев высокая лабильность может привести к недооценке величины их действия: она является результатом ферментного расщепления энкефалинов, веществ, имеющих наименьшие размеры молекулы.
Хотя опиатные пептиды имеют общие химические особенности, пути их биосинтеза различны. Синтез b-эндорфина (количество которого в организме наибольшее из всех эндорфинов) в гипофизе происходит как часть синтеза более крупной молекулы-предшественника (проопиомеланокортина, или ПОМК), которая также содержит полную последовательность актг, a-МСГ, b-МСГ и b-ЛПГ (рис. 69-2). Эта молекула-предшественник обладает также способностью образовывать другие формы эндорфина — фрагменты, называемые a-эндорфином и g-эндорфином. Внутри ПОМК существуют места отщепления «прогормоноподобных» веществ, что позволяет образоваться каждому из упомянутых выше пептидов в некоторых анатомических областях. Отсюда следует, что р-липотропный гормон, вероятно, является прогормоном для b-эндорфина. Хотя b-липотропный гормон обладает собственным спектром биологических свойств, его физиологическое значение у человека не определено. Важнее всего уяснить, что этот путь биосинтеза представляет собой единственный способ, посредством которого гипофиз продуцирует АКТГ. Следовательно, биосинтез АКТГ и биосинтез b-эндорфина сложным образом связаны между собой в гипофизе происхождением от одного и того же гена, который кодирует оба гормона. Всегда, когда в гипофизе секретируется АКТГ, там также происходит секреция b-эндорфина.
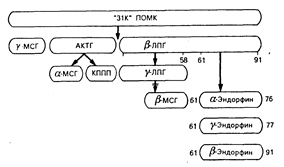
Рис. 69-2. Схема биосинтеза b-эндорфина в гипофизе.
Первоначальному синтезу единичного белка-предшественника — проопиомеланокортина (ПОМК) (мол. масса около 31 000) — способствует трансляция гена, кодирующего структуру адренокортикотропного гормона (АКТГ), b-липотропного гормона (b-ЛПГ) и b-эндорфина. Полученные в результате расщепления прогормоноподобные вещества могут генерировать образование других гормонов из того же самого предшественника, хотя такой процесс происходит не в гипофизе, а в других тканях. МСГ — меланоцитстимулирующий гормон; ЛПГ — липотропный гормон; КППП — кортикотропиноподобный промежуточный пептид; АКТГ — адренокортикотропный гормон.
В разных тканях происходят дифференцированные превращения ПОМК. Такое превращение может включать в себя метаболическую инактивацию пептидов, генерируемых из молекулы-предшественника в определенных анатомических областях. Например, хотя в гипофизе не происходит превращения AKTГ в более мелкие фрагменты, в гипоталамусе молекула-предшественник превращается в a-МСГ. b-МСГ генерируется в промежуточной доле мозга у животных низших видов. У человека отсутствует промежуточная доля мозга как четко выраженное единое анатомическое образование, и поэтому b-МСГ у человека продуцируется только в отдельных разрозненных клетках гипофиза. Эти клетки гипофиза секретируют b-эндорфин, b-липотропный гормон и АКТГ. В других клетках конечные продукты секреции определяются видом расщепления большой молекулы пептида-предшественника ферментными системами внутри этих клеток. Хотя клетки нескольких типов могут синтезировать один и тот же первичный генный продукт, конечный профиль гормональной секреции может быть совершенно разным.
Энкефалины ведут свое происхождение от разных предшественников, например в надпочечниках происходит биосинтез энкефалина, представляющего собой часть большой молекулы (мол. масса 50000) белка, — проэнкефалина-А, в котором содержится шесть повторов последовательности мет-энкефалина и одна структура лей-энкефалина (рис. 69-3). И снова типичные места отщепления «прогормоноподобных» веществ будут обусловливать структуру энкефалина. Динорфины и неоэндорфины ведут свое происхождение от третьей отдельной молекулы-предшественника — проэнкефалина-В. В структурах этих белков-предшественников закодированы дополнительные («загадочные») пептиды и они могут быть синтезированы в результате расщепления «прогормоноподобных» веществ. Неизвестно, секретируются ли эти таинственные пептиды in vivo, но некоторые из них были синтезированы химическим путем и, как установлено, могут оказывать биологическое действие.
Механизм действия. Как и для других пептидных гормонов, первый этап проявления биологической активности опиатных пептидов состоит в их связывании со специфическими рецепторами на плазматической мембране клеток-мишеней. Были охарактеризованы по меньшей мере пять функциональных типов опиатных рецепторов: взятые вместе с многочисленными видами эндогенных опиатных пептидов, они образуют очень сложную систему. Эта сложность еще более возрастает из-за различий в ответной реакции (десенсибилизация, толерантность и т. д.) на действие данного опиата на протяжении времени или в зависимости от вида его воздействия на рецепторы и вследствие того, что единичный нейрон (или эндокринная клетка) может секретировать более одного нейромедиатора.
Взаимодействие с рецептором ведет к образованию вторичного медиатора. Для опиатной системы взаимодействие с рецептором обычно приводит к снижению как базальной, так и стимулированной концентрации циклического АМФ, а длительное воздействие опиатными пептидами вызывает долговременное снижение его внутриклеточной концентрации. Однако в качестве компенсаторной реакции с течением времени постепенно число единиц аденилатциклазы возрастает. Это биохимическое изменение может физиологически коррелировать с толерантностью и тахифилаксией, требующими высоких доз опиатов для снижения уровней содержания циклического АМФ. Внезапная отмена опиатов в то время, когда клетка обогащена аденилатциклазой, устраняет угнетение этих единиц, что приводит к резкому повышению концентраций циклического АМФ и, возможно, вносит свой вклад в развитие синдрома отмены опиатов.
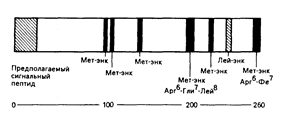
Рис. 69-3. Биосинтез предшественника энкефалинов (пре-проэнкефалин А) в надпочечнике.
Белок-предшественник содержит 260 аминокислот и имеет мол. массу около 50000. Отщепление «прогормоноподобных» веществ способно привести к образованию шести копий метионин—энкефалина (Мет—энк) и одной копии лейцин—энкефалина (.Лей—энк) из одной молекулы предшественника. Характеристикой секретируемых белков служит сигнальная пептидная последовательность в аминокислотном окончании (слева) белка-предшественника.
Эндокринология эндогенных опиатных пептидов. Эндокринная физиология. Биосинтез и секреция гипофизом АКТГ, b-эндорфина и b-липотропного гормона связаны как с нормальным, так и с патофизиологическим состоянием организма. При нормальном состоянии организма b-липотропный гормон циркулирует в крови в более высоких молярных концентрациях, чем b-эндорфин, но применявшимися радиоиммунными методами клинических исследований оба эти вещества определяются суммарно. Таким образом, уровни содержания иммунореактивного b-эндорфина отражают суммарные уровни содержания b-эндорфина и b-липотропного гормона. Такие радиоиммунные исследования обеспечивают получение клинических данных о связи биосинтеза АКТГ и биосинтеза р-эндорфина. Например, при аддисоновой болезни уровни содержания в плазме крови как АКТГ, так и иммунореактивного b-эндорфина повышены; аналогично заместительная терапия глюкокортикоидами уменьшает уровни содержания как АКТГ, так и b-эндорфина. Введение либерина кортикотропного гормона (ЛКГ) стимулирует высвобождение как АКТГ, так и иммунореактивного b-эндорфина одновременно. При синдроме Нельсона (развитии опухоли гипофиза после двусторонней адреналэктомии по поводу болезни Кушинга) повышены концентрации в плазме крови как АКТГ, так и иммунореактивного b-эндорфина. Эктопическое продуцирование актг опухолями сопровождается также избыточным содержанием иммунореактивного b-эндорфина. В последнем случае измерение уровня содержания иммунореактивного b-эндорфина может быть использовано в качестве маркера опухоли и в некоторых случаях служит для контролирования результатов лечения.
Болезнь Кушинга. Иммунореактивный b-эндорфин легко определяется и менее подвержен разрушению во время хранения и обработки, чем АКТГ. Кроме того, отделение больных, страдающих гипофиззависимой болезнью Кушинга, от здоровых людей на основании одного лишь определения уровня содержания в плазме крови АКТГ и концентрации кортизола обычно бывает ненадежным вследствие эпизодического высвобождения и быстрого клиренса АКТГ как у здоровых людей, так и у страдающих болезнью Кушинга больных (см. гл. 321 и 325). b-Эндорфин и b-липотропный гормон имеют более длительный период полувыведения из крови и, как указывалось выше, перекрестно реагируют во время проведения большинства радиоиммунных исследований.
Таблица 69-2. Эндокринные эффекты эндогенных опиатных пептидов и антагонистов опиатов
| Гормон | Опиатный пеитил | Налоксон |
| Лютеинизирующий гормон (ЛГ) | i | t |
| Фолликулостимулирующий гормон (ФСГ) | i | t |
| Соматотропный гормон (СТГ) | t | ^ |
| Прол актин | t | <-.» или [ |
| Антидиуретический гормон (АДГ) | i | t |
| Адренокортикотропный гормон (АКТГ) | I | t |
| Кортизол | t | |
| Инсулин | i | <-> |
| Глюкагон | t | •'-* |
| Соматостатин | i | ^^' |
Совместное измерение в плазме крови концентрации иммунореактивного b-эндорфина и кортизола может быть эффективным при диагностике болезни Кушинга. Кроме того, определение реакции гипофиза на такие воздействия, как подавление дексаметазоном или стимуляция метирапоном (Metyrapone), также можно осуществить, используя радиоиммунное определение концентрации b-эндорфина. Следовательно, измерение уровней содержания b-эндорфина и b-липотропного гормона в плазме крови может дополнить, если не заменить, измерения концентрации АКТГ при оценке гипофизадреналовых реакций в случаях подозрения на болезнь Кушинга. Кроме того, при патофизиологических состояниях меняется картина гормональной секреции. Например, опухоли гипофиза, вызывающие болезнь Кушинга, могут секретировать b-липотропный гормон и b-эндорфин в измененных соотношениях по сравнению с их секрецией гипофизом в норме.
Либерины. Существуют два основных подхода к определению роли эндорфинов при нормальном физиологическом состоянии организма (табл. 69-2). Первый заключается в определении эффектов прямого введения эндогенных опиатных пептидов в большой круг кровообращения или в цереброспинальную жидкость животных или человека. Например, фармакологическое введение b-эндорфина вызывает увеличение секреции соматотропного гормона (СТГ), пролактина и аргинин-вазопрессина (АВП), а также снижение секреции АКТГ, кортизола, лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (,ФСГ). Считают, что влияние b-эндорфина на гипофиз не является результатом прямого действия на эту железу, а осуществляется путем усиления высвобождения нейрогормонов гипоталамуса. Отсюда следует, что эндорфины не являются прямыми гипоталамическими либеринами.
Альтернативный подход к выяснению роли эндогенных ониатных пептидов заключается в определении эффектов селективных антагонистов опиатов, таких как налоксон. Такие вещества блокируют действие эндогенносекретируемых опиатов, выявляя стимулирующую, или физиологическую, роль опиатных пептидов. Введение налоксона вызывает повышение уровней содержания ЛГ, ФСГ и АКТГ в плазме крови и предотвращает опосредуемое стрессом повышение уровней содержания пролактина. Однако налоксон не вызывает стойкого снижения концентрации СТГ у страдающих акромегалией больных или концентрации пролактина у страдающих пролактиномами.
Эндокринология размножения. Введение антагонистов опиатов изменяет картину секреции гонадотропных гормонов, что заставляет предположить наличие определенной роли эндорфинов в осуществлении нормальной функции размножения. Эти эффекты зависят от пола, возраста, вида животных и уровня содержания в плазме крови половых гормонов (стероидов) во время проведения исследования. Введение антагонистов опиатов вызывает изменение частоты и амплитуды пульсирующей секреции ЛГ, что позволяет предположить наличие тонизирующего угнетения гонадотропных гормонов эндогенными опиатными пептидами. b-Эндорфины присутствуют в гипоталамической портальной крови приматов: их концентрации высоки во время среднефолликулярной и лютеальной фаз менструального цикла, но фактически неопределимы во время менструации. Подобным же образом наличие очень низких или вообще неопределимых уровней содержания b-эндорфина в портальной крови гипоталамуса у самок животных с удаленным яичником позволяет предположить, что овариальные гормоны могут модулировать или играть разрешающую роль в секреции гипоталамического эндорфина и что b-эндорфин может регулировать нормальный менструальный цикл.
Кроме того, эндорфины могут играть определенную роль в достижении организмом половой зрелости. В пубертатном возрасте у человека происходит постепенное увеличение уровней содержания b-эндорфина в.плазме крови, а у животных по мере их полового созревания происходит снижение чувствительности гипоталамо-гипофизарной системы к опосредованному опиатами угнетению секреции ЛГ. Таким образом, «избавление» от тонизирующего угнетения может быть сигналом наступления половой зрелости.
В ряде случаев нарушение репродуктивной функции у некоторых женщин связано с изменениями уровней содержания эндогенных опиатных пептидов. Чрезмерный стресс часто вызывает задержку полового созревания у девочек. Подобным же образом у женщин в периоды стресса могут происходить задержки или полное отсутствие менструаций, что, возможно, отражает влияние повышенных под воздействием стресса уровней содержания эндорфинов в центральной нервной системе и последующее подавляющее действие на секрецию гонадотропных гормонов гипофизом. У женщин-наркоманок менструальный цикл редко бывает ненарушенным (это происходит даже прежде, чем начнется заметное снижение массы тела), что опять-таки позволяет предположить наличие связи между активацией опиатных рецепторов и угнетением эндокринной репродуктивной функции. И, наконец, уровни содержания иммунореактивного b-эндорфина в периферической крови (отражающие гипофизарную секрецию) увеличиваются в несколько раз при интенсивных и регулярных физических нагрузках, и развитие олигоменореи или аменореи у женщин-спортсменок может отражать действие индуцированного физической нагрузкой b-эндорфина на секрецию гонадотропного гормона. Отсюда следует, что при некоторых стрессовых ситуациях эндогенные опиатные пептиды могут служить в качестве средства для подавления овуляции. И, наконец, кроме головною мозга и гипофиза, система предшественника — про-АКТГ/эндорфин — имеется в яичниках, семенниках и плаценте, что также позволяет предположить наличие у эндогенных опиатов определенной роли в обеспечении нормальной репродуктивной функции.
Сахарный диабет. Эндорфинсодержащие клетки состоят в близком родстве с инсулинсодержащими клетками поджелудочной железы. b-Эндорфин стимулирует высвобождение инсулина и глюкагона и угнетает секрецию соматостатина; эти эффекты могут устраняться налоксоном. У больных, страдающих инсулиннезависимым диабетом и получающих хлорпропамид, после употребления алкоголя развивается внезапный прилив крови к лицу. Эта реакция блокируется налоксоном и восстанавливается под действием опиатных пептидов, что относят на счет повышенной чувствительности больных диабетом к эндогенным опиатам. Однако существенного влияния эндорфинов на метаболизм углеводов или какого-либо вклада b-эндорфина в патофизиологию диабета не установлено.
Нейрофизиология эндогенных опиатных пептидов. Анатомическая локализация. b-Эндорфин присутствует в гипофизе и в головном мозге. В гипофизе человека АКТГ и эндорфинсодержащие клетки обнаруживаются в переднемедиальной области передней доли, у задней границы передней доли и в нервных волокнах задней доли. По данным гистохимических исследований в гипофизе выявляют самое высокое содержание эндорфинов в организме.
Нейроны, в которых происходит биосинтез эндорфина, располагаются в гипоталамусе и имеют длинные отростки, проникающие в другие отделы головного мозга. Например, отделы головного мозга, связанные с лимбической системой, содержат значительные количества иммунореактивного b-эндорфина, что позволяет предположить наличие его влияния на память, способность к обучению и эмоции.
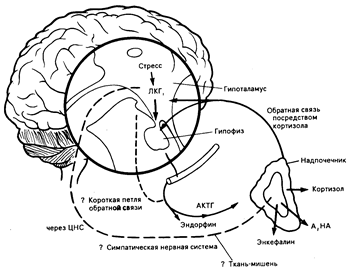
Рис. 69-4. Гормональная реакция на стресс, показывающая выделение эндогенных опиатных пептидов и других гормонов в кровь и цереброспинальную жидкость.
ЛКГ — либерин кортикотропного гормона; А — адреналин; НА — норадреналин; ЦНС — центральная нервная система; АКТГ — адренокортикотропный гормон.
Нейроны, содержащие энкефалины, еще шире распространены в центральной нервной системе. Концентрации энкефалинов особенно высоки в заднем столбе спинного мозга, т. е. в той области, которая содержит опиатные рецепторы и проводящие пути, участвующие в передаче болевых импульсов (см. гл. 3). Энкефалины присутствуют также в пищеварительном тракте. Их концентрации в нервном сплетении мышечной оболочки кишечника выше, чем в головном мозге. Энкефалины синтезируются в хромаффинных клетках надпочечников и хранятся вместе с катехоламинами в тех же самых секреторных гранулах. Высвобождение энкефалина происходит как часть симпатической реакции на стресс вместе с высвобождением адреналина и норадреналина (рис. 69-4). Аналогично этому концентрации энкефалинов в крови высоки при феохромоцитоме.
Передача болевых импульсов и уменьшение боли. Эндогенные опиатные пептиды играют определенную роль в регуляции передачи болевых импульсов. В заднем роге спинного мозга энкефалины высвобождаются интерцептивными нейронами, которые взаимодействуют с афферентными волокнами болевой чувствительности, идущими с периферии. Эти передающие болевые импульсы волокна образуют синапсы в сером веществе заднего рога с вторым комплектом нейронов; эти волокна поднимаются вверх через ствол спинного мозга и пересекают его, образуя латеральный спиноталамический путь. Высвобождение энкефалинов (на которое могут влиять нисходящие нейроны из вышерасположенных центров) подавляет выделение вещества Р (медиатора, опосредующего передачу болевых импульсов) из афферентных волокон, входящих в состав заднего рога (см. гл. 3).
Микроинъекции b-эндорфинав центральную нервную систему у животных вызывают обезболивание. Электрическая стимуляция областей головного мозга, участвующих в передаче болевых импульсов, таких как перивентрикулярная серая область, вызывает обезболивание, сопровождаемое увеличением концентрации эндорфинов и энкефалинов в цереброспинальной жидкости. У лишенной коры головного мозга кошки локальное введение энкефалина селективно блокирует самопроизвольное включение нейронов, участвующих в передаче болевых импульсов.
Что касается людей, то повышенные уровни содержания b-эндорфина были обнаружены в цереброспинальной жидкости больных, страдающих хроническими болями, вызванными злокачественными опухолями или каузалгией. Как и у животных, электрическая стимуляция соответствующих мест в перивентрикулярной области у людей вызывает обезболивание, сопровождаемое увеличением концентрации иммунореактивного b-эндорфина, а введение b-эндорфина в цереброспинальную жидкость больных, страдающих злокачественными опухолями в четвертой стадии, приводит к долговременному обезболиванию без развития морфиноподобных системных побочных эффектов.
Акупунктура и эффекты плацебо. Эндогенные опиатные пептиды могут опосредовать обезболивание, вызванное с помощью акупунктуры. В ряде исследований было установлено, что обезболивание в результате акупунктуры сопровождалось увеличением уровня содержания эндорфинов в цереброспинальной жидкости, в то время как одновременное с акупунктурой введение налоксона (антагониста опиатов) блокировало это обезболивание. Таким же образом действие плацебо может являться отражением способности организма призывать на помощь систему эндогенных опиатных пептидов. При проведении исследований, источником болевых импульсов в которых служила экстракция зуба, обезболивание, достигнутое с помощью плацебо, устранялось введением налоксона. Аналогично этому феномены толерантности к плацебо и зависимости от него согласуются с известными свойствами системы эндогенных опиатов.
Влияние эндогенных опиатов на поведение. Введение опиатных пептидов животным в дозах, меньших, чем необходимые для достижения обезболивания, приводит к развитию специфических и поразительных поведенческих реакций. У крыс, которым внутрицеребрально вводили b-эндорфин, развилось состояние, подобное кататонии вследствие тяжелых гипокампальных судорожных припадков. Наблюдаются также некоторые стереотипные формы поведения, такие как «встряхивания вымокшей собаки». У кошек развивается реакция ярости.
Кроме того, было высказано предположение, что аномальные концентрации эндогенных опиатов или их рецепторов могут играть причинную роль или вносить свой вклад в серьезные психические заболевания. В одном исследовании больных шизофренией было установлено, что при введении налоксона у них уменьшалась частота развития слуховых галлюцинаций. Однако другие попытки выявить корреляцию между уровнями содержания b-эндорфина с состояниями депрессии, мании или другими психическими заболеваниями были безуспешны.
Было также постулировано, что привыкание людей к какому-либо агенту и раздражителю связано с измененными уровнями содержания эндогенных опиатных пептидов. Восприимчивость к наркотикам и развитие наркомании у определенных лиц может быть вызвано генетически предопределенным дефектом в системе эндогенных опиатов. Кроме того, некоторые типы обычного поведения были описаны как обусловленные «привыканием». Марафонский бег и другие виды интенсивных физических упражнений резко увеличивают концентрации b-эндорфина в организме, что вызвало к жизни гипотезу, в которой предполагается, что деятельность такого рода порождает внутреннюю (центральную) «самокомпенсацию». Однако не было получено данных об уровнях содержания эндогенных опиатов в центральной нервной системе (возможно, в строго локализованных анатомических областях), которые поддержали бы эту гипотезу.
Другие физиологические и патофизиологические реакции. Термогенез. Опиатные пептиды могут играть определенную роль в развитии реакции адаптации к воздействию тепла. Долговременное воздействие высоких температур на животных, за которым следовало введение налоксона, приводило к быстрому повышению температуры тела. Пептиды, родственные эндорфину и закодированные в молекуле-предшественнике, такие как g-меланоцитстимулирующий гормон (g-МСГ), вызывают быстрое снижение температуры тела.
Стресс. Повышенные уровни содержания в сыворотке крови АКТГ и кортизола во время стресса сопровождаются повышенной секрецией b-эндорфина и b-липотропного гормона. Аналогично этому, при стрессе повышаются концентрации пролактина в сыворотке крови. Такое увеличение концентрации пролактина блокируется введением налоксона, что позволяет предположить, что вызванное стрессом выделение пролактина отчасти стимулировано эндогенными опиатами.
У некоторых видов животных вызываемое стрессом повышение аппетита блокируется налоксоном. Эндокринологическая и центральная роль либерина кортикотропного гормона (ЛКТГ) в качестве гормона стресса связывает секрецию гипофизарного b-эндорфина и b-липотропного гормона с АКТГ и кортизолом, делая их частью реакции на стресс, хотя орган (ы)-мишень для действия b-эндорфина и b-липотропного гормона неизвестен (см. рис. 69-4).
Контролирование аппетита. Эндорфины могут играть роль в нормальной регуляции аппетита и быть ответственными за нарушения пищевого режима. У мышей и крыс, страдающих генетически обусловленным ожирением, отмечается выраженное увеличение содержания b-эндорфина, b-липотропного гормона и АКТГ в гипофизе. Инъекция b-эндорфина в головной мозг таких животных или подкожная инъекция им морфина вызывает стремление к еще большему увеличению потребления пищи. Такое увеличение аппетита у животных, страдающих генетически обусловленным ожирением, отсутствующее у здоровых животных из контрольной группы, блокируется налоксоном. Снижение стремления к увеличению потребления пищи наблюдается и у людей после введения антагонистов опиатов. Местом действия эндорфина, оказывающего влияние на аппетит, по-видимому, является гипоталамус (его паравентрикулярное ядро). В дополнение к потенциальным местам действия эндорфина в центральной нервной системе опиатные рецепторы присутствуют и в пищеварительном тракте. Кроме того, b-эндорфин синтезируется в поджелудочной железе, где он стимулирует (паракринным путем) выделение инсулина, что, возможно, приводит к повышению аппетита и изменению характера утилизации глюкозы.
Артериальное давление и шок. Тяжелая степень гипотензии или шок стимулируют высвобождение из гипофиза АКТГ, b-липотропного гормона и b-эндорфина и последующее увеличение концентраций кортизола в сыворотке крови. Однако по большей части такая реакция на стресс может быть вредной для организма. При сепсисе уровни содержания иммунореактивного Р-эндорфина в сыворотке крови повышаются прежде, чем разовьется гипотензия. Введение налоксона частично или полностью восстанавливает величину артериального давления при экспериментальном геморрагическом, неврогенном (спинальном) и септическом шоке, в результате чего смертность в результате последнего снижается. Количество b-эндорфина, выделившегося из гипофиза в таких условиях, по-видимому, регулируется (по крайней мере у некоторых видов животных); введение налоксона во время опосредованного эндотоксином шока приводит к еще большему увеличению уровня содержания b-эндорфина в сыворотке крови, а это позволяет предположить, что секреция b-эндорфина находится под контролем обратной связи. Предполагаемая короткая петля угнетающей обратной связи от гипофиза к гипоталамусу может действовать через кровеносную систему, поскольку подбугорная область гипоталамуса является единственной областью головного мозга, которая лежит кнаружи от гематоэнцефалического барьера. Результаты единичного исследования позволяют предположить, что эндорфины гипофиза могут попадать в гипоталамус через гипоталамо-гипофизарную систему кровообращения, что можно рассматривать как его распространение в обратном направлении. Важно отметить, что внести свой вклад в развитие септического шока (в дополнение к эндогенным опиатам) могут несколько биохимических медиаторов: тромбоцитактивирующий фактор, метаболиты арахидоновой кислоты, кинины, иммунорегуляторные пептиды и другие вещества. Относительный вклад этих факторов в гипотензию, по-видимому, варьирует у разных видов животных. Отсюда следует, что для выяснения роли эндорфинов и энкефалинов в патофизиологии септического шока у человека необходимо проведение дальнейших исследований.
Регуляция дыхания. Опиатные рецепторы присутствуют в участках ствола мозга, ответственных за регуляцию дыхания, но роль их в этом процессе не установлена. По результатам единичного исследования, лечение налоксоном больных, страдающих хроническим обструктивным заболеванием легких, увеличивало степень вентиляторной реакции на резистентность воздушных путей и приводило к усилению одышки. Однако, согласно результатам другого исследования, налоксон не стимулировал реакцию при вдыхании двуокиси углерода. Кроме того, вентиляторная реакция на кратковременную гипоксию у здоровых взрослых людей под действием налоксона не изменялась. Все это ставит под сомнение основную роль эндорфинов в регуляции дыхания. Скорее, они могут участвовать в тонкой регулировке вентиляции и могут быть ответственны за различия в нарушениях дыхания у разных людей. И, наоборот, их действие может усиливаться при повреждении нормальных регуляторных механизмов.
Взаимодействия с иммунной системой. Эндогенные опиаты обеспечивают биохимическую связь между головным мозгом, нейроэндокринной системой и иммунной системой и могут служить объяснением концепции о том, что эмоциональный стресс сопровождается нарушением иммунного ответа, возможно, приводя к увеличению частоты случаев инфекционных заболеваний и замаскированных злокачественных-опухолей в условиях неоптимального иммунологического надзора.
Опиатные рецепторы выявляли в гранулоцитах, лимфоцитах и моноцитах человека, и существуют определенные данные, свидетельствующие о том, что лимфоциты продуцируют b-эндорфиноподобное вещество. К сожалению, данные о потенциальной регулирующей роли опиатных пептидов в иммунном ответе противоречивы: одни указывают на их подавляющее действие, другие — на стимулирующее, в зависимости от применяемых при исследованиях систем оценки биологической эффективности. Опиатные пептиды стимулируют хемотаксис макрофагов у человека, угнетают или увеличивают пролиферацию лимфоцитов и по-разному влияют на естественную активность клеток-киллеров. Суммарное влияние опиатов на реактивность иммунной системы in vivo требует уточнения.
Клиническое значение эндогенных опиатов. Результаты исследований эндогенных опиатных пептидов позволяют надеяться на то, что эти вещества могут с успехом применяться при лечении некоторых заболеваний, в особенности связанных с репродуктивной функцией, контролированием аппетита и ожирением. Изучение путей и способов передачи болевых импульсов имеет важное значение для эффективного лечения болевых ощущений. Углубленное понимание механизма действия и клеточных реакций на опиатные пептиды может способствовать проникновению в патофизиологию привыкания, толерантности и синдрома отмены, наркотиков и помочь в разработке оптимальной терапии этих нарушений. В результате проводимых исследований природы и свойств эндогенных опиатов может быть получена информация, относящаяся к психическому здоровью и психическим заболеваниям, а исследования налоксона ставят цель сделать его средством, участвующим в лечении септического шока.
Знание химического строения молекулы эндогенных опиатов позволяет осуществить химический синтез этих веществ и их аналогов. Наиболее эффективно в клинической практике могут быть использованы аналоги, обладающие любым из следующих свойств: большой продолжительностью действия, биоусвояемостью при пероральном применении, повышенной активностью, селективностью в пределах широкого спектра действия, уменьшенной частотой побочных эффектов и отсутствием привыкания.
На основе исследования эндогенных опиатных пептидов были выяснены многие важные принципы. Биологические свойства пептида естественного происхождения зависят не только от его строения, но также и от его локализации и типа клетки, с которой он взаимодействует. Например, одно и то же химическое вещество может действовать и как нейромодулятор обезболивания, и как гормон, влияющий на секрецию гонадотропинов.
Кроме того, исследованиями системы опиатных пептидов был продемонстрирован фундаментальный фармакологический принцип. Рецепторы, которые связывают лекарственные средства, в норме взаимодействуют с эндогенными лигандами. Такие эндогенные вещества могут принадлежать к химическому классу, отличному от того класса, к которому принадлежит соответствующее лекарственное средство (например, морфин является алкалоидом, а эндорфин —пептидом). Кроме того, эти эндогенные вещества могут быть более сильнодействующими и вызывать развитие меньшего числа побочных эффектов, чем находящееся в употреблении общепринятое фармакологическое средство. Применение этого принципа может помочь обнаружить эндогенные субстанции, обладающие действием, сходным с действием дигоксина, трициклических антидепрессантов и бензодиазепинов. Выделение таких веществ и определение их химического строения обеспечит получение новых биологически активных средств.
Дата добавления: 2015-07-25; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ГЛАВА 68. МЕТАБОЛИТЫ АРАХИДОНОВОЙ КИСЛОТЫ И ИХ РОЛЬ В МЕДИЦИНЕ | | | ГЛАВА 73. НЕРВНО-ПСИХИЧЕСКАЯ АНОРЕКСИЯ И БУЛИМИЯ |