
|
Читайте также: |
Теплоемкость и ее виды.Удельной теплоемкостью с называют количество теплоты q, которое требуется для изменения температуры единицы количества вещества на один градус: 

Различают теплоемкости: массовую с, объемную с' и мольную  , которые имеют размерность: с, Дж/кг · К; с', Дж/нм3 · К;
, которые имеют размерность: с, Дж/кг · К; с', Дж/нм3 · К;  , Дж/ моль · К. Эти теплоемкости связаны между собой соотношениями
, Дж/ моль · К. Эти теплоемкости связаны между собой соотношениями

 (1.2)
(1.2)
где νо, ρо, μ – удельный объем, плотность и молекулярная масса газа при нормальных условиях (ρо = 1,013 · 105 Па, То = 273 К).
Теплоемкость зависит от физической природы рабочего тела, температуры, термодинамического процесса.
В технической термодинамике наиболее часто используют изобарную теплоемкость ср (при р = const) и изохорную сν (при ν = const).
Связь между этими теплоемкостями определяется соотношением Майера для идеального газа:
ср - сν = R, (1.3)
где R – газовая постоянная, Дж/кг · К.
Зависимостью теплоемкости от температуры часто пренебрегают, и тогда количество теплоты в изобарном и изохорном процессах находится из выражений
Qp = Мср (Т2 – Т1) или qр = ср (Т2 – Т1);
(1.4)
Qν = Мсν (Т2 – Т1) или qν = сν (Т2 – Т1).
Из аналитического выражения первого закона термодинамики можно получить соотношения для определения изменения внутренней энергии Δu и энтальпии Δh, справедливые для всех термодинамических процессов:
dqν = du; du = cνdT; Δu = u2 – u1 = cν (Т2 – Т1);
(1.5)
dqр = du + рdν = dh; dh = cpdT; Δh = h2 – h1 = cp (Т2 – Т1).
Поскольку теплоемкость изменяется с температурой, в зависимости от интервала температур различают истинную с и среднюю сср теплоемкости. Истинная теплоемкость  соответствует бесконечно малому интервалу температур, а средняя -
соответствует бесконечно малому интервалу температур, а средняя -  конечному интервалу изменения температуры. Значения теплоемкостей основных газов приводятся в справочниках, учебных пособиях в зависимости от температуры [2, 6].
конечному интервалу изменения температуры. Значения теплоемкостей основных газов приводятся в справочниках, учебных пособиях в зависимости от температуры [2, 6].
Энтальпия. Вводится расчетным путем: полная – H = U + pV или удельное значение h = u + pν, энтальпия представляет некоторую энергию, равную сумме внутренней энергии и произведения давления на объем. Единицей измерения энтальпии Н является джоуль (Дж) или h, Дж/кг. Энтальпия является функцией состояния. Так как в изобарном процессе dH = dQ, то можно сказать, что энтальпия – это количество теплоты, подведенное в изобарном процессе.
Энтропия. Единицей измерения энтропии S является Дж/К и удельной s – Дж/ кг·К. Это функция состояния вводится расчетным путем и имеет полный дифференциал 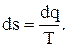 Количество теплоты в термодинамическом процессе
Количество теплоты в термодинамическом процессе

Если представить термодинамический процесс в T-s диаграмме, то площадь под кривой процесса характеризует количество подведенной или отведенной теплоты.
Энтропию нельзя измерить, но по физическому смыслу она является мерой температурной ценности теплоты, ее способности превращения в работу. Можно сказать также, что энтропия характеризует потерю работы вследствие необратимости реальных процессов (при этом энтропия возрастает).
Обычно при расчете термодинамических процессов определяют не абсолютные значения u, h, s, а изменение в процессе Δu, Δh, Δs.
Дата добавления: 2015-07-25; просмотров: 251 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Термодинамическая система, параметры состояния | | | Работа и теплота |