
Читайте также:
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
СТЕПЕНЬ ОКИСЛЕНИЯ И СОСТАВЛЕНИЕ
ХИМИЧЕСКИХ ФОРМУЛ
Состав химических соединений выражают химическими формулами, при составлении которых используется характеристика состояния элемента в соединении – степень окисления (с. о.).
| Степень окисления – условный заряд атома в химическом соединении. |
Степень окисления при необходимости указывают над символом элемента в формуле или римской цифрой в названии вещества.
Для расчета степеней окисления элементов используют следующие правила:
v степень окисления элемента в простом веществе равна нулю 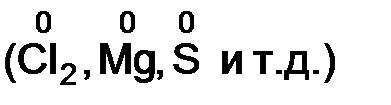 ;
;
v степень окисления кислорода в большинстве сложных веществ равна -2  ;
;
v степень окисления водорода и щелочных металлов в большинстве сложных веществ равна +1  ;
;
v алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, в ионе – его заряду.
Пример. Рассчитайте степени окисления элементов в соединениях: а) NH3; б) P2O5; в) NH4NO3.
Решение
а) С. о. водорода равна +1. С. о. азота рассчитываем, приравнивая алгебраическую сумму с. о. атомов, образующих данную молекулу, нулю. Сумма с.о. атома азота (x) и трех атомов водорода 3(+1)
x + 3(+1) = 0, откуда x = -3. 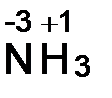 .
.
б) С.о. кислорода равна -2. Аналогично предыдущему составляем выражение алгебраической суммы с.о. двух атомов фосфора (2х) и пяти атомов кислорода:
2х + 5(-2) = 0, откуда х = +5.  .
.
в) Большинство элементов в соединениях проявляют несколько различных степеней окисления. Рассчитать степени окисления атомов азота в соединении NH4NO3 можно, разделив эту соль на ионы NH4+ и NO3-. Далее для каждого иона составляем выражение суммы степеней окисления, включая неизвестную степень окисления атома азота х, и приравниваем его заряду иона.
Для иона NH4+:
х + 4 (+1) = +1, х = -3;
для иона NO3-:
х + 3(-2) = -1, х = +5.
Формула нитрата аммония с указанием с. о. азота:  .
.
Дата добавления: 2015-07-25; просмотров: 79 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Системами противопожарной защиты. | | | КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |