
|
Читайте также: |
Хирургу любого профиля постоянно приходится иметь дело с лечением ран От целесообразности и эффективности применяемых методов лечения зависит длительность заживления раны, а следовательно и продолжительность нетрудоспособности больного
Для правильной оценки изменений в ране и результатов воздействия на нее в желаемом направлении, врачу необходимо иметь глубокие знания по патофизиологии, патоморфологии и клинике раневого процесса Этому может способствовать изучение цитологии ран как показателя процесса ее заживления
В 1913 г Currel и Dehelly предложили метод цитологического исследования раневого отделяемого Этот метод получил распространение после опубликования М П Покровской и М С Макаровым в 1942 г монографии " Цитология раневого экссудата как показатель процесса заживления раны " Авторы, по предложению Н Н Бурденко, поставили перед собой цель найти методику, позволяющую хирургу определять напряженность реактивных способностей организма, следить за динамикой процесса заживления раны.
Методика, предложенная М.П. Покровской и М.С. Макаровым (1942) заключается в следующем предварительно обезжиренное, вымытое и проведенное через пламя горелки предметное стекло прикладывают к тому участку раны, который необходимо исследовать На стекле, продвигая его вдоль раны, делают целый ряд мазков - отпечатков В процессе нанесения отпечатков послойно снимается сначала отделяемое раны, затем поверхность стекла приходит в непосредственное соприкосновение с тканями и на стекле остаются клетки экссудата и микроорганизмы, которые находятся на самой раневой поверхности. Затем рекомендуется мазки - отпечатки высушить на воздухе и погрузить в фиксатор (смесь эфира и этилового спирта поровну) на 15 минут или в чистый метиловый спирт на 5 минут. Окрашивание мазков - отпечатков осуществляется по методу Романовского- Гимза и по Граму (для выявления микроорганизмов).
М.Ф. Камаевым (1970)предложен метод поверхностной биопсии, который заключается во взятии материала путем легкого соскоба поверхностного слоя раны специальным шпателем. Вместо такого шпателя можно пользоваться ручкой хирургического скальпеля. Полученный материал переносят на стекло, равномерно распределяя тонким слоем, фиксируют и окрашивают по способу Романовского. Преимуществом такого метода является то, что удается получить клеточные элементы не только экссудата и поверхностного (зернисто- фиброзного) слоя раны,
1. ОБСЛЕДОВАНИЕ ЧЕЛЮСТНО -ЛИЦЕВОГО БОЛЬНОГО
но и слоя новообразованных клеток. Поэтому можно получить больше данных о течении регенеративного процесса в ране. Морфологический состав раневого экссудата представлен следующими клетками: нейтрофилами, моноцитами, плазматическими и гигантскими многоядерными клетками, эозинофилами.
Полиморфноядерные нейтрофильные лейкоциты (микрофаги) - это клетки сосудистого происхождения. Главное их назначение - это активный фагоцитоз микроорганизмов, попавших в рану. Наличие нейтрофилов в ране указывает на активность защитной реакции организма в борьбе с инфекцией. Фагоцитированные микроорганизмы находятся на ранних стадиях переваривания. Лишь при слабой сопротивляемости организма или высокой вирулентности микрофлоры можно видеть нейтрофилы, содержащие огромное количество микроорганизмов, переваривание которых не доходит до конца. Массовое разрушение фагоцитов должно обратить на себя внимание хирурга, который должен принять меры к уменьшению интоксикации организма в ответ на внедрившуюся инфекцию. Для анаэробной инфекции характерна слабая воспалительная реакция, на месте ранения гноя нет, лишь есть кровянистое отделяемое, лейкоцитов в ране мало, фагоцитоз низкий.
Следует обращать внимание на появление нейтрофилов с пикнозом, гиперхрома-тозом и кариорексисом ядра. Такие массовые дегенеративные изменения клеток указывают на активизацию вирулентной микрофлоры.
Моноцитарные клетки раневого экссудата появляются в отпечатках позже полиморф-ноядерных нейтрофилов. К клеткам моноцитарного ряда относятся полибласты, гистиоци-ты (макрофаги Мечникова), профибробласты, фибробласты. Большое число по- либластов с явлениями дегенерации указывает на высокую вирулентность микрофлоры. Наличие же макрофагов - благоприятный признак и указывает на эффективное лечение больного. Макрофаги исчезают из экссудата по мере того, как рана покрывается чистыми грануляциями. Количество профибробластов возрастает с освобождением раны от инфекции, а массовое их выявление наблюдается в активно эпителизирующихся ранах. Плазматические клетки, гигантские многоядерные клетки, эозинофилы, микрофлора раны также находится в раневом экссудате. Появление плазматических клеток в большом количестве указывает на медленное заживление раны, а гигантских многоядерных клеток на применение сильных антисептиков или наличии в ране инородного тела (шелковой или кетгутовой лигатуры). Нахождение в мазках - отпечатках эозинофилов является благоприятным признаком.
В зависимости от цитологической картины заживления, раны подразделяются на определенные периоды и фазы. Так, М.Ф. Камаев (1970) различает следующие периоды и фазы раневого процесса:
• I. Ранний период - продолжительность 12 часов. Основные данные цитограмм: клеточные элементы нормальной крови, фибрин.
• II. Дегенеративно- воспалительный период - продолжительность 5-8 дней. Данные цитограмм: полиморфноядерные лейкоциты покрывают поле зрения, детрит, единичные одноядерные клетки.
• III. Регенеративный период (с 8-10 дней до 30 дней):
Первая фаза - характеризуется наличием малоизмененных полиморфноядерных лейкоцитов в значительном или умеренном количестве, полибласты (3-5 в поле зрения);
Вторая фаза - дальнейшее снижение количества лейкоцитов, их фрагментация и появление клеток типа фибробластов и макрофагов. М.И. Кузин и Б.М. Костюченок (1981) в динамике раневого процесса прослеживают три
основных периода:
• 1) расплавление некротических масс и очищение от них раневого дефекта через воспаление;
• 2) пролиферация соединительнотканных элементов с формированием грануляционной ткани, которая выполняет рану;
• 3) фиброзирование грануляционной ткани с образованием рубца и эпителизацией последнего.
При цитологическом исследовании мазков В.Т. Карпухин (1957) рекомендует учитывать количество и характер микрофлоры (стафилококки, стрептококки, смешанная флора и др.}, степень фагоцитоза (завершенный, незавершенный, отсутствие его), клеточные элементы экссудата и степень их дегенерации. Подсчет рекомендуется проводить в 12-15 полях зрения, общее число клеток делится на количество полей зрения и получается среднее число. Микроорганизмы автор учитывал методом "плюсов": "+'"- единичные колонии в поле зрения, "++"-часто встречающиеся колонии, "+++"- равномерно покрыт микробами весь препарат, "++++"-густо усеяны колониями все поле зрения. При учете нейтрофилов один плюс (+) соответство-
1 3 Цитология ран и гнойного экссудата
вал 10 клеткам обнаруженным в поле зрения Учитывая остальные клеточные элементы экссудата один плюс (+) ставили при обнаружении одной клетки в поле зрения
Для унифицирования методики подсчета клеточных элементов в цитограмме раневого экссудата Л И Абаскулиева (1962) предлагает обследовать мазки по специальной схеме
Количественную, цитологическую и бактериологическую характеристику процесса заживления гнойных ран лица и шеи дал В И Польский и соавт (1965) Они впервые привели количественные цитологические нормативы различных фаз течения гнойных ран
Цитологическое исследование динамики заживления гнойных ран челюстно- лицевой области свидетельствует о том, что у всех без исключения больных раневой процесс носит отчетливо выраженный фазный характер В первые часы в препаратах наблюдалось большое количество бактерий, скопление спущенных эпителиальных клеток, окруженных лейкоцитами, основную массу которых составляли нейтрофилы В этот период кроме нейтрофилов в ране определялись лимфоциты, единичные плазматические клетки и моноциты Среди соединительнотканных клеток встречались единичные макрофаги с фагоцити-рованными микробами, эритроцитами и обрывками лейкоцитов Через сутки после операции количество слущенных эпителиальных клеток резко уменьшалось и одновременно в них усиливались дегенеративные процессы Количество лимфоцитов увеличивалось, по-прежнему абсолютное их большинство составляли малые лимфоциты Количество макрофагов увеличивалось На 2-3 сутки после операции в препаратах наблюдался почти полный распад эпителиальных клеток Количество дегенеративно измененных сегментоядерных нейтрофилов значительно превышало число неизмененных Бактериальная обсемененность резко снижалась по
|
|
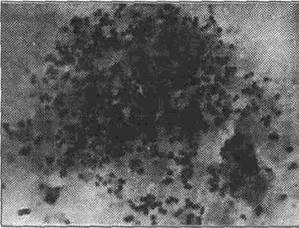
Рис. 1.3.1. Скопление микроорганизмов вокруг лейкоцитов у больного с одонтоген. ным абсцессом. Мазок гнойного экссудата. Микрофото. Ув. 90х10.
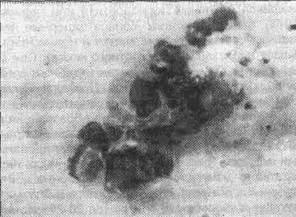
Рис. 1.3.2. Наличие микроорганизмов в раневых отпечатках больного флегмоной. Макрофаг в состоянии фагоцитоза.
Дата добавления: 2015-07-25; просмотров: 206 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Капитаненко А.М., Дочкин И.И., 1988 ). | | | Микрофото. Ув 90х10 |