









2s 2p
 |  |  |  |
1s
 |
Si
+14
при возбуждении е- распариваются и переходят от s-орбиталей на свободные р-орбитали,
возможна гибридизация,
элементы подгруппы углерода – окислители и восстановители
ПР: окислители СО2 атомы max степени окисления
восстановители СH4 атомы min степени окисления
«элементы главных подгрупп проявляют сходную степень окисления»
(физ.смысл) окисление – процесс отдачи е-, степень окисления - количество отданных е-,
элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
ст.окисления и валентность углерода 0 -4 +2 +4 (.. IV)
кремния 0 -4 +4 (..IV)
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: IVА max(+)степень окисления +4
с ростом величины порядкового номера в главной подгруппе окислительные свойства ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «C - Pb»
свойства водородных соединений, оксидов элементов
водородные соединения
| RH4 | |
| СH4 | газ |
| SiH4 | газ |
СH4, SiH4- летучие соединения с полярной ковалентной хим.связью,
с ростом порядкового номера в главной подгруппе устойчивость водородных соединений ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет их связь с атомами водорода
ПР: PbH4 в свободном виде не выделен
высшие оксиды
| RО2 | ||
| СО2 | газ | кислотный |
| SiO2 | тв. | кислотный |
| GeO2 | амфотерный | |
| SnO2 | амфотерный | |
| PbO2 | амфотерный |
с ростом порядкового номера в главной подгруппе сила кислородсодержащих кислот ¯
(физ.смысл) атомы О у центр.атома смещают е- плотность связи Н-О,
при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры центр.атома , уменьшается смещение е- плотности, эл.диссоциация уменьшается
электронное строение атомов углерода, степени окисления
углерод С 2s 2p
 |  |  |  |
1s
 C
C
+6
ПС №6 2период IVА
строение е-оболочек +6С 1s22s2р2, р-элемент,
при возбуждении е- распариваются и переходят от s-орбитали на свободные р-орбитали,
углерод – окислитель и восстановитель,
C 0 + 4e- ® C -4
C 0 - 2e- ® C +2
C 0 - 4e- ® C +4
ст.окисления 0 –4 +2 +4
ПР: С СH4 СО2
в природе углерод встречается в виде хим.соединений и в виде простых в-в(есть аллотропия)
 ПР: СaСО3 известняк, мел, мрамор
ПР: СaСО3 известняк, мел, мрамор
строение и физ.свойства аллотропных модификаций углерода
алмаз | тв.кристал-твердый-прозрачный(преломляет свет)-изолятор, ´растворим H2O, rС=3,5
C(IV) 0 хим.связь одинарная неполярная ковалентная(sp3 Ð109°)
/|\ ¹ атомная крист.решётка
 при 1700°C алмаз переходит в графит
при 1700°C алмаз переходит в графит
графит | тв.кристал-мягкий(расслаивается)-непрозрачный-проводник, ´растворим H2O, rС=2,3
 - C(IV) 0 хим.связь неполярная ковалентная(sp2 Ð120°) 3 s-cвязи + 1 p-связь
- C(IV) 0 хим.связь неполярная ковалентная(sp2 Ð120°) 3 s-cвязи + 1 p-связь
/ \ ¹ слоистые структуры
при 2000°C р=10*1010Па графит переходит в алмаз
карбин -СºС-.. тв. кристал-непрозрачный-полупроводник, ´растворим H2O, rС=2
хим.связи двойные.. неполярные ковалентные(sp Ð180°)
при 2000°C карбин переходит в графит
¹ линейные структуры
аморфный углерод содержится в составе сажи-кокса-древесного угля и состоит из мелких кристаллов графита
хим.свойства углерода
УГЛЕРОД С
3. неметалл
окислитель
 *C + 2H2 T Pt/Ni CH4
*C + 2H2 T Pt/Ni CH4
 2S + C T CS2 сероуглерод
2S + C T CS2 сероуглерод
 2C + Ca T CaC2 карбид кальция
2C + Ca T CaC2 карбид кальция
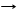 3C + 4Al T Al4C3 карбид алюминия
3C + 4Al T Al4C3 карбид алюминия
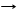 *3C + CaО T CaC2 + СО (реакция диспропорционирования)
*3C + CaО T CaC2 + СО (реакция диспропорционирования)
восстановитель
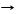
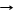 *С + О2 СО2 (нач/нагревание) 2С + О2 2СО
*С + О2 СО2 (нач/нагревание) 2С + О2 2СО
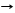
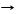 С + О2 СО2 (нач/нагревание) С + CО2 T 2СО получение генераторного газа
С + О2 СО2 (нач/нагревание) С + CО2 T 2СО получение генераторного газа
*C + H2O 1000°С Û СO + Н2 получение водяного газа(СО+H2+H2O)
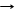 *C + 2CuO T 2Cu + СО2
*C + 2CuO T 2Cu + СО2
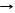 *4HNO3 + 3C 3CO2 + 4NO + 2H2O
*4HNO3 + 3C 3CO2 + 4NO + 2H2O
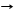 4HNO3 конц + C 4NO2 + CO2 + 2H2O
4HNO3 конц + C 4NO2 + CO2 + 2H2O
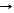 C + 2H2SO4 конц CO2 + 2SO2 + 2H2O
C + 2H2SO4 конц CO2 + 2SO2 + 2H2O
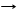 2C + BaSO4 T BaS + 2CO2
2C + BaSO4 T BaS + 2CO2
4. топливо, кокс в металлургии, активированный уголь как адсорбент,
алмазы в инструментах-украшениях,
графит для электродов для электролиза-карандашей-смазки,
получение карбида кальция СаС2, резины
получение и свойства оксида углерода(II)
ОКИСЬ УГЛЕРОДА(II) СО
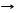 1.2. НСООН T H2SO4конц Н2О + СО
1.2. НСООН T H2SO4конц Н2О + СО
1.3.* 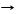
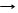 С + О2 T СО2 (нач/нагревание) С + CО2 T 2СО получение генераторного газа(СО..)
С + О2 T СО2 (нач/нагревание) С + CО2 T 2СО получение генераторного газа(СО..)
*C + H2O 1000°С Û СO + Н2 получение водяного газа(СО+H2+H2O..)
*CH4 + 2H2O 1000°С Û Ni СO + 3Н2 получение синтез-газа(СО+H2..)
*неполное сгорание топлива при недостатке О2
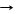 2С + О2недостаток T 2СО
2С + О2недостаток T 2СО
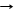 *СO2 + Zn T ZnO + CO
*СO2 + Zn T ZnO + CO
2.(н.у.)газ без цвета-запаха(ядовит), ¯растворим Н2О
 3.1. CО O ®С (III) +2 хим.связи полярные ковалентные + дополнительная ковалентная связь, где
3.1. CО O ®С (III) +2 хим.связи полярные ковалентные + дополнительная ковалентная связь, где
С+ "акцептор е-"(свободная p-орбиталь)
3. несолеобразующий оксид (не реагирует с водой) О- "донор е-" (неподелённая е- пара)
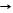 *СО + KOH p HCOOK формиат калия донорно-акцепторный механизм
*СО + KOH p HCOOK формиат калия донорно-акцепторный механизм
сильный восстановитель
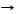 *2СО + О2 T 2СО2 + 557КДж
*2СО + О2 T 2СО2 + 557КДж
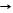 СО + Cl2 T COCl2 фосген
СО + Cl2 T COCl2 фосген
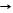 *СО + CuO T Cu + CO2
*СО + CuO T Cu + CO2
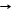 3СО + Fe2O3 T 2Fe + 3CO2
3СО + Fe2O3 T 2Fe + 3CO2
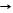 5СО + Fe T Fe(CO)5 пентакарбонил железа
5СО + Fe T Fe(CO)5 пентакарбонил железа
СО + 2Н2 T р Û ZnO CH3OH метанол
получение, свойства и применение оксида углерода(IV)
ОКСИД УГЛЕРОДА (IV) CO2
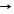 1.2. CaCО3 + 2HCl CaCl2 + H2O + CO2
1.2. CaCО3 + 2HCl CaCl2 + H2O + CO2
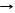 CaCO3 T CaO + CO2
CaCO3 T CaO + CO2
2.(н.у.) газ без цвета-запаха, растворим H2O, TплавСО2=-56,6°C(возгонка)
3.1. СО2 O=С=О (IV) +4 хим.связь полярная ковалентная, но молекула неполярная(Ð180°)
3. кислотный оксид
*CO2 + H2O Û H2CO3(нестойкая кислота, существует только в растворе)
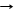 *CO2 + CaO CaCO3
*CO2 + CaO CaCO3
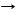
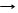 *2KOH + CO2 K2CO3 + H2O затем K2CO3 + CO2 + H2O 2КHCO3
*2KOH + CO2 K2CO3 + H2O затем K2CO3 + CO2 + H2O 2КHCO3
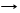 Fe(OH)2 + CO2 FeCO3 + H2O
Fe(OH)2 + CO2 FeCO3 + H2O
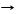 CO2 + Са(OH)2 CaCO3¯ + H2O помутнение известковой воды качественная реакция
CO2 + Са(OH)2 CaCO3¯ + H2O помутнение известковой воды качественная реакция
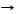 CO2 + H2O + 2NH3 (NH4)2CO3
CO2 + H2O + 2NH3 (NH4)2CO3
окислитель (max степень окисления)
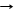 *СO2 + 2Mg T 2MgO + C
*СO2 + 2Mg T 2MgO + C
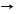 СO2 + Zn T ZnO + CO
СO2 + Zn T ZnO + CO
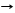 *С + CО2 T 2СО
*С + CО2 T 2СО
свойства угольной кислоты
УГОЛЬНАЯ КИСЛОТА H2CO3
1.2. CO2 + H2O Û H2CO3(нестойкая кислота, существует только в растворе)
3. слабая кислота
*электролитическая диссоциация ступенчатая(2-основная кислота)
H2CO3 Û H+ + HCO3-
HCO3-Û H+ + CO32-
реакции замещения с металлами до Н
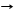 *H2CO3 + Mg MgCO3 + H2
*H2CO3 + Mg MgCO3 + H2
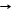 2H+ + Mg Mg2+ + H2
2H+ + Mg Mg2+ + H2
реакции обмена с основными оксидами
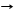 *H2CO3 + CaO H2O + CaCO3¯
*H2CO3 + CaO H2O + CaCO3¯
реакции обмена с основаниями-солями(условия необратимости..)
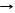 *H2CO3 + 2NaOH Na2CO3 + 2H2O реакция нейтрализация
*H2CO3 + 2NaOH Na2CO3 + 2H2O реакция нейтрализация
H+ + OH-® H2O эквивалентные количества H+ и OH- нейтрализуют друг друга
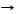 *H2CO3 + Са(OH)2 CaCO3¯ + H2O помутнение известковой воды качественная реакция,
*H2CO3 + Са(OH)2 CaCO3¯ + H2O помутнение известковой воды качественная реакция,
в избытке кислоты осадок растворяется CaCO3 + H2CO3 ®Ca(НCO3)2
при нагревании осветлённого раствора ® осадок Ca(НCO3)2 T ®CaCO3¯ + Н2О + СО2
получение кислых солей: реакции основания и избытка кислоты
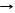 H2CO3 + NaOH NaНCO3 + H2O
H2CO3 + NaOH NaНCO3 + H2O
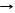 *H2CO3 + CaCl2 CaCO3¯ + 2HCl
*H2CO3 + CaCl2 CaCO3¯ + 2HCl  HNO3
HNO3
*реакция разложения ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
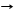 H2CO3 T CO2 + H2O H3PO4
H2CO3 T CO2 + H2O H3PO4
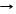 4. огнетушитель(H2CO3 T CO2 + H2O)
4. огнетушитель(H2CO3 T CO2 + H2O)
фруктовая вода(H2CO3 Û CO2 + H2O в герметичной бутылке рСО2 устанавливается хим.равновесие,
в открытой бутылке хим.равновесие нарушается и происходит вспенивание)
карбонаты, качественная реакция на карбонат-ионы
соли CO32- карбонаты - средние соли угольной кислоты ПР: Na2CO3 CaCO3
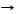 1.3. CO2 + H2O + NH3 (NH4)НCO3
1.3. CO2 + H2O + NH3 (NH4)НCO3
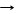 (NH4)НCO3 + NaCl NH4Cl + NaHCO3¯(выпадает в осадок из-за невысокой растворимости)
(NH4)НCO3 + NaCl NH4Cl + NaHCO3¯(выпадает в осадок из-за невысокой растворимости)
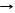 NaHCO3 T Na2CO3 + CO2 + H2O
NaHCO3 T Na2CO3 + CO2 + H2O
2. тв.кристал, ´растворимы Н2О(кроме солей щелочных металлов)
3. соли слабой кислоты
*электролитическая диссоциация
 реакции гидратации(образуются кристаллогидраты)
реакции гидратации(образуются кристаллогидраты)
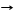 *Na2CO3 + 10H2O Na2CO3*10H2O
*Na2CO3 + 10H2O Na2CO3*10H2O
реакции гидролиза
*2Na2CO3 + H2O Û NaOH + NaHCO3
реакции обмена с кислотами-основаниями-солями(условия необратимости реакции..)
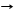 *MgCO3 + CO2 + H2O Mg(HCO3)2
*MgCO3 + CO2 + H2O Mg(HCO3)2
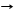 Na2CO3 + 2HCl 2NaCl + H2O + CO2
Na2CO3 + 2HCl 2NaCl + H2O + CO2
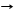 CO32- + 2H+ H2O + CO2
CO32- + 2H+ H2O + CO2
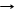 *Na2CO3 + Ca(ОН)2 CaCO3¯ + 2NaОН
*Na2CO3 + Ca(ОН)2 CaCO3¯ + 2NaОН
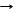 *Na2CO3 + CaCl2 CaCO3¯ + 2NaCl
*Na2CO3 + CaCl2 CaCO3¯ + 2NaCl
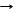 CO32- + Ca2+ CaCO3¯ качественная реакция
CO32- + Ca2+ CaCO3¯ качественная реакция
 реакции разложения
реакции разложения
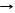 *CaCO3 T CaO + CO2
*CaCO3 T CaO + CO2
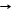 2Ag2CO3 T 4Ag + CO2 + O2
2Ag2CO3 T 4Ag + CO2 + O2
4.Na2CO3 кальцинированная сода, кристаллическая сода Na2CO3*10H2O ® стекло, мыло, лекарства
NaHCO3 питьевая сода
K2CO3 ® стекло, мин.удобрения
электронное строение атомов кремния
Дата добавления: 2015-07-25; просмотров: 39 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Фосфор 3s 3p 3d | | | кремний Si 3s 3p 3d |