
Читайте также:
|
 моль-экв.
моль-экв.
Вещества взаимодействуют в эквивалентных количествах:
 моль-экв.
моль-экв.
 мл.
мл.
По закону Фарадея:
 А.
А.
масса прокорродировавшего железа: 
 г.
г.

Коррозия Fe-Fe3C (углеродистая сталь)
Среда: кислая в отсутствии воздуха (нет О2)

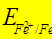 <
<  Þ Fe - участок
Þ Fe - участок

Fe 3 C - участок

Fe – 2e ® Fe2+ Поляризационная кривая
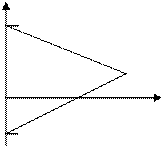

 2H+ + 2e ® H2
2H+ + 2e ® H2

 Е корр
Е корр
 I корр
I корр
Основными характеристиками электрохимической коррозии: Екор - стационарный коррозионный потенциал (устанавливается на поверхности металла, при котором протекают сопряженные реакции ионизации Ме и восстановления Ох;
Iкор -ток коррозии или плотность тока коррозии iкор (показывают скорость коррозионного процесса в электрических единицах). Скорость коррозии - потери металла в единицу времени или величина тока или плотности тока коррозии:

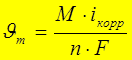
для Fe скорость коррозии: m = 1г/м2×сут соотв., i корр=0,04А/м2

Скорость коррозии лимитируется скоростью самой медленной стадии Þ чаще катодная реакция.
Диаграмма с лимитирующим катодным контролем
 |
Е А
Ек орр
Е К
i корр
Если коррозия с водородной деполяризацией Þ самая медленная стадия: Н+ +  → Надс
→ Надс
Þ зависит от природы катодных участков, от присутствие в составе металла примесей (Hg, Pb, Cd, Zn замедляют скорость коррозии в целом).
Если коррозия с кислородной деполяризацией Þ лимитирующая стадия - диффузия молекул О2 через диффузионный слой.
Скорость определяется предельной плотностью тока i пр:
iпр= 4F.DO2.cO2.δ-1,
где DO2 - коэффициент диффузии кислорода;
cO2 - концентрация кислорода в растворе;
δ - толщина диффузионного слоя.
Существенно увеличивает скорость коррозии с поглощением кислорода перемешивание коррозионной среды.
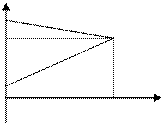
Если лимитирует - анодная реакция окисления металла - пассивация (Cr, Al, Ti).
Пассивация - образование на поверхности металла плотной труднорастворимой защитной пленки из продуктов коррозии, которая тормозит анодный процесс и скорость электрохимической коррозии в целом.
Диаграмма с лимитирующим анодным контролем
 |
ЕА
Екорр
ЕК
i корр
К методам защиты от коррозии относятся:
– легирование (обычно компонентами, повышающими пассивацию металла (Cr, Ni, Al, Mn, Mo, Cu);
– защитные металлические (анодные и катодные) и неметаллические покрытия;
– электрохимическая защита: а) катодная защита – подключение защищаемого изделия к отрицательному полюсу внешнего источника тока, при этом оно становится катодом и не окисляется, б) присоединение к защищаемому изделию протектора – металла с более отрицательным значением потенциала, в) анодная защита – подключение защищаемого металла к положительному полюсу внешнего источника тока и перевод его в пассивное состояние, применима к металлам, способным пассивироваться (Cr, Al, Ti, Zr и др.);
– изменение свойств коррозионной среды (удаление растворенного кислорода, увеличение pH, добавление ингибиторов коррозии).
Рассмотрим способ защиты металла от электрохимической коррозии с помощью металлического покрытия. По характеру поведения металлических покрытий при коррозии их можно разделить на катодные и анодные. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. При повреждении покрытия возникает коррозионный элемент, в котором основной металл служит анодом и растворяется, а металл покрытия – катодом, на котором восстанавливается окислитель. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. В этом случае основной металл служит катодом коррозионного элемента, поэтому он не корродирует при повреждении покрытия.
Пример 4.1. Имеется спай олова (Sn) с серебром (Ag). Определите возможность коррозии при эксплуатации изделия в щелочной среде (рН = 9) при контакте с кислородом. Напишите уравнения возможных коррозионных процессов.
Решение. По табл.1 приложения определим стандартные электродные потенциалы металлов:
 B,
B, 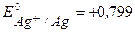 B,
B,
т.к. 
 , то в образующейся гальванической паре анодом будет олово, а катодом – серебро.
, то в образующейся гальванической паре анодом будет олово, а катодом – серебро.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 B,
B,
 B.
B.
Поскольку  <
<  <
<  , то возможной будет только коррозия олова под действием кислорода:
, то возможной будет только коррозия олова под действием кислорода:
A– : Sn → Sn2+ + 2  .
.
K+ : O2 + 2H2O + 4  → 4OH–.
→ 4OH–.
Пример 4.2. При коррозии железного изделия с поглощением кислорода за 3 мин образовалось 0,125г Fe(OH)2. Вычислите объем кислорода, израсходованного на коррозию железа, силу коррозионного тока и массу металла, разрушенного коррозией.
Решение. Рассчитаем количество моль-эквивалентов образовавшегося Fe(OH)2:
 моль-экв.
моль-экв.
Поскольку все вещества взаимодействуют в эквивалентных количествах, то разрушилось 2,8.10-3 моль-эквивалентов Fe и израсходовалось столько же моль-эквивалентов O2. 
 моль-экв.
моль-экв.
Тогда объем кислорода (н.у.), израсходованного на коррозию железа:
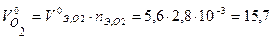 мл.
мл.
По закону Фарадея рассчитаем силу коррозионного тока:
 А.
А.
Определим массу прокорродировавшего железа: 
 г.
г.
Пример 4.3. Предложите анодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 7, р газ =1. Напишите уравнения коррозионных процессов при нарушении целостности покрытия.
Решение. В качестве анодного покрытия для Fe можно использовать металлы с более отрицательным значением потенциала, (например, Zn, Cr, Al и др.). Например, выберем хром, стандартный потенциал  В, более отрицательный, чем
В, более отрицательный, чем  В.
В.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
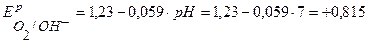 В.
В.
т.к.  <
<  , то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
, то при нарушении целостности хромового покрытия на железном изделии роль анода будет выполнять хром.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна коррозия хрома с кислородной и водородной деполяризацией:
A- : Cr → Cr3+ + 3 
K+ : O2 + 2H2O + 4  → 4OH-
→ 4OH-
2H2O + 2  → H2 + 2OH-
→ H2 + 2OH-
В нейтральной среде хром отличается высокой коррозионной стойкостью вследствие склонности к пассивации. Продукты коррозии хрома (Cr2O3 , Cr(OH)3 и др.) образуют на поверхности металла плотные труднорастворимые оксидно-солевые пленки, обладающие защитными свойствами, которые затрудняют контакт металла с окислителем и тормозят дальнейший процесс коррозии. Поэтому, хотя термодинамически коррозия возможна, железное изделие c хромовым покрытием реально не разрушается под действием коррозии.
Пример 4.4. Предложите катодное покрытие для защиты железного изделия от электрохимической коррозии в кислородсодержащей среде при рН = 8 и р газ =1. Напишите уравнения процессов в коррозионном гальваническом элементе при нарушении целостности покрытия.
Решение. В качестве катодного покрытия для Fe можно использовать металлы с более положительным значением потенциала, (например, Ni, Cu, Ag и др.). Например, выберем медь, стандартный потенциал  В, более положительный, чем
В, более положительный, чем  .
.
Так как  <
<  , то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
, то при нарушении целостности медного покрытия на железном изделии роль анода будет выполнять железо.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
 В.
В.
Так как  <
<  <
<  , то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
, то в данной среде термодинамически возможна коррозия железа с кислородной деполяризацией и невозможна коррозия с выделением водорода. Уравнения коррозионных процессов:
A- : Fe → Fe2+ + 2 
K+ : O2 + 2H2O + 4  → 4OH--
→ 4OH--
Железное изделие при этом будет разрушаться.
Пример 4.5. Напишите уравнения электрохимической коррозии пары Sn-Zn при рН=5 и 298 К. Сколько и какого металла прокорродировало, если в процессе коррозии поглотилось 56 мл кислорода и выделилось 22,4 мл водорода? Определите, чему равен коррозионный ток, если продолжительность коррозии 20 мин.
Решение. Стандартные потенциалы металлов:
 B,
B,  B,
B,
т.к.  <
<  то в заданной гальванической паре анодом будет цинк, а катодом – олово.
то в заданной гальванической паре анодом будет цинк, а катодом – олово.
По уравнению Нернста определим равновесные потенциалы вероятных окислителей (Н+ и О2):
 В,
В,
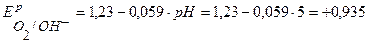 В.
В.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия цинка с кислородной и водородной деполяризацией:
A- : Zn → Zn2+ + 2 
K+ : O2 + 2H2O + 4  → 4OH-
→ 4OH-
2H2O + 2  → H2 + 2OH-.
→ H2 + 2OH-.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 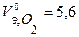 л/моль,
л/моль,  л/моль):
л/моль):
 моль-экв,
моль-экв,
 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 1,2.10-2 моль-эквивалентов вещества. По закону эквивалентов такое же количество вещества растворится на аноде:  . Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка
. Масса прокорродировавшего цинка (с учетом массы моля эквивалента цинка 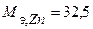 г/моль) равна:
г/моль) равна:
 г.
г.
Величина коррозионного тока определяется по закону Фарадея:
 А.
А.
Пример 4.6. Выберите протектор для защиты стальной конструкции (Fe) в кислой среде (рН=4) на воздухе. Напишите уравнения процессов коррозии. Рассчитайте, как изменится масса протектора, если за некоторое время в процессе коррозии поглотилось 112 мл кислорода и выделилось 112 мл водорода.
Решение. При протекторной защите к металлическому изделию непосредственно или через металлический проводник подсоединяются металл или сплав с более отрицательным значением потенциала, чем потенциал защищаемого изделия. Для железа ( В) в качестве анодного протектора можно использовать магний (
В) в качестве анодного протектора можно использовать магний ( В), цинк (
В), цинк ( В), алюминий (
В), алюминий ( В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как
В). При контакте с окислителем металл протектора растворяется, а защищаемое изделие не разрушается. Например, выберем магний. Так как  <
<  , то в паре с железом магний будет анодом.
, то в паре с железом магний будет анодом.
Согласно уравнению Нернста равновесные потенциалы вероятных окислителей (Н+ и О2) равны:
 В,
В,
 В.
В.
Так как  <
<  ,
,  , то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
, то в данной среде термодинамически возможна электрохимическая коррозия магниевого протектора с кислородной и водородной деполяризацией:
A- : Мg → Мg2+ + 2 
K+ : O2 + 4H+ + 4  → 2H2О
→ 2H2О
2H+ + 2  → H2.
→ H2.
В соответствии с заданием определим количество моль-эквивалентов поглотившегося кислорода и выделившегося водорода (условия считаем нормальными, 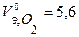 л/моль,
л/моль,  л/моль):
л/моль):
 моль-экв,
моль-экв,
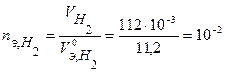 моль-экв.
моль-экв.
Таким образом, на катоде претерпело изменение 3.10-2 моль-эквивалентов окислителя. По закону эквивалентов такое же количество протекторного материала растворилось на аноде:  моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния
моль-экв. Масса растворившегося протектора (с учетом молярной массы эквивалента магния 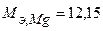 г/моль) равна:
г/моль) равна:
 г.
г.
Дата добавления: 2015-07-11; просмотров: 77 | Нарушение авторских прав