
|
Читайте также: |
а — пузырь с разрывом; б — микропузыри в слое окисла (вакуумная пористость); в — отслаивание; г — растрескивание при сдвиге; д — растрескивание на углах и ребрах.
35. К какому взаимодействию сводиться коррозия в среде чистого воздуха с кислородом
36. С чем связано увеличение скорости коррозии при увеличении температуры связано со снижением перенапряжения выделения водорода, а наряду с этим — ускорение диффузии, уменьшение электросопротивления среды.
37. Толщина средней окисной плёнки 400-5000 Å
38. Толщина какой окисной плёнки определяется весовым методом выше 5000 Å (толстые)
39. Эрозия – это постепенное механическое разрушение металла
40. Биохимическая коррозия – это процесс, связанный с воздействием микроорганизмов на металл.
41. Методы оценки коррозии: качественные и количественные (весовой и объёмный методы)
42. Глубинный показатель коррозии (формула) 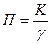
43. Катодные реакции:
1. Восстановление катиона: Н+ + е→1/2Н2, Ag+ + е→Ag.
2. Восстановление аниона: S2О82- + 2е →2SO42-, MnO4- + e→ MnO42-
3. Восстановление молекул растворенного в электролите
газа: O2 + 2H2O+ 4e → 4OH-, Cl2 + 2e → 2Cl-.
4. Восстановление окисных или гидроокисных пленок:
Fe3O4 + H2O + 2e → 3FeO + 2OH-, Fe(OH)3 + e → Fe(OH)2 + OH-.
5. Восстановление органических молекул:
R + 2H+ + 2e → RH2, RO + 4H+ + 4e→RH2 + H2O.
44. Анодные реакции чаще всего сводятся к образованию кислорода, реже наблюдается частичное образование хлора; одновременно происходит (в той или иной степени) разрушение анода, кроме тех случаев, когда анод нерастворим.
45. Зависимость защитных свойств плёнки от толщины. Лучшими защитными свойствами обладают тонкие пленки. Однако толщина пленки, строго говоря, не является все же критерием защитной способности.
46. Какой из металлов наиболее подвержен коррозии в газовой среде при 800о С за время 24 часа: железо, медь, никель, вольфрам
47. Что происходит со скоростью коррозии при увеличении температуры? увеличивается
48. Какой должна быть оксидная плёнка, чтобы обладать хорошими защитными свойствами? сплошной, беспористой.
49. Помимо сплошности оксидная плёнка должна обладать хорошим сцеплением с металлом, должна быть достаточно прочной и эластичной. Коэффициенты теплового расширения пленки и металла должны быть достаточно близки. Наконец, пленка должна быть химически стойкой в условиях воздействия на нее коррозионной среды.
50. Самые короткие во времени коррозионные испытания лабораторные.
 |  | |||
 |
КОРРОЗИЯ МЕТАЛЛОВ
 |
Дата добавления: 2015-07-11; просмотров: 89 | Нарушение авторских прав