
Читайте также:
|
Состояние системы с минимальной свободной энергией есть состояние термодинамического равновесия:
Изобарно-изотермические условия (P = const, T = const):
ΔG = 0 dG = 0, d2G > 0
Термодинамическим равновесием называется такое состояние системы, которое при постоянстве внешних условий не изменяется во времени, причем эта неизменяемость не обусловлена каким-либо внешним процессом.
(химическое равновесие - частный случай термодинамического равновесного состояния.)
В общем виде условие химического равновесия (уравнение Гиббса – Дюгема) можно записать следующим образом: 
Подставив в него зависимость химического потенциала от концентрации, получаем:

Для изобарно-изотермического процесса аналогичным образом можно получить выражение Изотермы химической реакции:

Если система находится в состоянии химического равновесия, то изменение ТД потенциала равно нулю (DG=0) получаем:

Здесь сi и рi – равновесные концентрации [Ci] и давления исходных веществ и продуктов реакции. Уравнение связывает константу равновесия со стандартным изменением энергии Гиббса в ходе реакции и позволяет ответить на вопрос, будет ли химическая реакция протекать самопроизвольно при данных концентрациях Сi (давлениях Рi) реагентов:
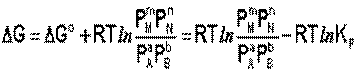
Направление химической реакции определяется по величине отношения:
1. Пс/ Kc = 1; DG = 0; =
2. Пс/ Kc < 1; DG < 0; ->
3. Пс/ Kc >1; DG >0; <-
Влияние температуры на положение равновесия получаем для зависимости константы равновесия от температуры уравнение– изобары Вант-Гоффа,
связывающую изменение константы химического равновесия с тепловым эффектом реакции:


Продифференцировав выражение по температуре,

(чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия.)
Дата добавления: 2015-07-11; просмотров: 177 | Нарушение авторских прав