
Читайте также:
|
Таблица 1
Стандартные потенциалы металлических электродов при Т = 298 К
| Электродная система |  , В , В
| Электродная система |  , В , В
|
| Li+/Li | –3,05 | Ni2+/Ni | –0,25 |
| K+/K | –2,92 | Sn2+/Sn | –0,14 |
| Cs+/Cs | –2,92 | Pb2+/Pb | –0,13 |
| Ba2+/Ba | –2,91 | Fe3+/Fe | –0,04 |
| Ca2+/Ca | –2,87 | 2H+/H2 | 0,00 |
| Na+/Na | –2,71 | Sn4+/Sn | +0,01 |
| Mg2+/Mg | –2,36 | Bi3+/Bi | +0,22 |
| Be2+/Be | –1,85 | Cu2+/Cu | +0,34 |
| Al3+/Al | –1,66 | Cu+/Cu | +0,52 |
| Ti2+/Ti | –1,63 | 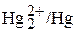
| +0,79 |
| Mn2+/Mn | –1,18 | Ag+/Ag | +0,80 |
| Zn2+/Zn | –0,76 | Hg2+/Hg | +0,85 |
| Cr2+/Cr | –0,91 | Pd2+/Pd | +0,99 |
| Cr3+/Cr | –0,74 | Pt2+/Pt | +1,19 |
| Fe2+/Fe | –0,44 | Au3+/Au | +1,50 |
| Cd2+/Cd | –0,40 | Au+/Au | +1,69 |
| Co2+/Co | –0,28 |
Таблица 2
Потенциалы водородного и кислородного электродов
при различных условиях (Т=298 К)
| Среда и активность Н+, моль/л | Парциальное давление | |||
| водорода | кислорода | |||
| 101,325 кПа = = 1атм (стандартное) | 5·10-5кПа = = 5·10-7атм (воздух) | 101,325 кПа = = 1 атм (стандартное) | 21,3 кПа = = 0,21 атм (воздух) | |
 , В , В
|  , В , В
| |||
Кислая,
рН = 0; 
| 0,000 | +0,186 | +1,229 | +1,180 |
Нейтральная,
рН = 7;
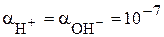
| –0,414 | –-0,228 | +0,815 | +0,805 |
Щелочная,
рН = 14; 
| –0,828 | –0,641 | +0,401 | +0,391 |
Таблица 3
Стандартные потенциалы окислительно-восстановительных
и газовых электродов
| Окисленная форма | Восстановленная форма | Уравнение реакции |  , В , В
|
| Br2 | Br– | Br2 + 2ē = 2Br – | +1,070 |
| Cl2 | Cl– | Cl2 + 2ē ® 2Cl– | +1,360 |
| ClО3– | Cl– | ClО3– + 6ē + 6Н+ = Cl– + 3H2O | +1,350 |
| Co3+ | Co2+ | Co3+ + ē = Co2+ | +1?840 |
| Cr3+ | Cr2+ | Cr3+ + ē = Cr2+ | –0,407 |
| Cr2O72– | Cr3+ | Cr2O72– + 6ē + 14H+ = 2Cr3+ + 7H2O | +1,330 |
| Cu2+ | Cu+ | Cu2+ + ē = Сu+ | +0,153 |
| F2 | 2F– | F2 + 2ē = 2F– | +2,87 |
| Fе3+ | Fе2+ | Fе3+ + ē = Fе2+ | +0,770 |
| J2 | J– | J2 + 2ē = 2J – | +0,536 |
| MnО4– | Mn2+ | MnO4– + 5ē + 8H+= Mn2+ + 4H2O | +1,507 |
| PbО2 | Pb2+ | PbО2 + 2ē + 4H+ = Pb2+ + 2H2O | +1,450 |
| S0 | S2– | S0 + 2ē = S2– | –0,480 |
| S2О82– | 2SО42– | S2О82– + 2ē = 2SО42– | +2,010 |
| Sn4+ | Sn2+ | Sn4+ + 2ē = Sn2+ | +0,150 |
Таблица 4
Средние коэффициенты активности различных ионов
| Ионы | Концентрация раствора, моль/л | |||
| 0,00025 | 0,00125 | 0,0025 | 0,025 | |
| Cu2+, Fe2+, Zn2+ | 0,870 | 0,749 | 0,675 | 0,405 |
Таблица 5
Энергия Гиббса образования некоторых ионов в водных растворах [3]
| Ион |  , кДж/моль , кДж/моль
| Ион |  , кДж/моль , кДж/моль
|
| Ag+ | 77,20 | Mg2+ | –455,24 |
| Al3+ | –489,80 | Mn2+ | –229,91 |
| Cd2+ | –77,65 | Ni2+ | –45,56 |
| Cu2+ | 66,20 | Pb2+ | –24,30 |
| Fe2+ | –84,80 | Zn2+ | –146,50 |
Таблица 6
Перенапряжение выделения водорода  и кислорода
и кислорода 
на различных электродах при t = 25ºС и i=10 А/м2
| Металл |  , В , В
|  , В , В
| Металл |  , В , В
|  , В , В
|
| Pb | 1,23 | 0,69 | Cu | 0,48 | 0,40 |
| Hg | 1,07 | – | Ti | 0,40 | – |
| Cd | 1,05 | 0,90 | Fe | 0,36 | 0,30 |
| Zn | 0,83 | – | Ni | 0,30 | 0,70 |
| Al | 0,70 | – | Co | 0,20 | 0,24 |
| Sb | 0,67 | – | Pd | 0,15 | 0,94 |
| Ag | 0,65 | 0,50 | W | 0,13 | – |
| Графит | 0,65 | 1,1 | Pt (гладкая) | 0,07 | 1,18 |
| Sn | 0,63 | – | Au | 0,04 | 1,34 |
| Mn | 0,50 | – | Pt (платинированная) | 0,00 | 0,70 |
| Bi | 0,48 | – |
Таблица 7
Отношение объемов оксида и металла
| Металл | Оксид | Vок /VМе | Металл | Оксид | Vок /VМе |
| Ag | Ag2O | 1,58 | Mg | MgO | 0,79 |
| Al | Al2O3 | 1,27 | Mo | MoO3 | 3,45 |
| Ba | BaO | 0,73 | Na | Na2O | 0,59 |
| Ca | CaO | 0,63 | Ni | NiO | 1,52 |
| Cu | CuO | 1,74 | Pb | PbO | 1,15 |
| Cr | Cr2O3 | 2,02 | Pt | PtO | 1,56 |
| Fe | FeO | 1,77 | Sn | SnO2 | 1,33 |
| Fe | Fe3O4 | 2,09 | Ti | TiO2 | 1,76 |
| Fe | Fe2O3 | 2,14 | W | WO3 | 3,36 |
| K | K2O | 0,40 | Zn | ZnO | 1,58 |
| Li | Li2O | 0,57 | Zr | ZrO2 | 1,60 |
Дата добавления: 2015-07-10; просмотров: 36 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| постановлений по вновь открывшимся обстоятельствам | | | ВОПРОС. |