
Читайте также:
|
Разрешение затруднений классической физики в описании явлений микромира было связано с осознанием ограниченности применения ее моделей для этой области, необходимости смены аксиоматического аппарата и разработки новых методов исследования. Завершилось оно рождением новой механики - квантовой - теории, раскрывающей способ описания и законы движения микрочастиц во внешних полях. У ее истоков стояли выдающиеся ученые глобального масштаба, в большинстве своем лауреаты самой престижной в мире премии - Нобелевской: Н.Бор (1885-1962), М.Борн (1882-1970), Луи де Бройль (1892-1987), В.Гейзенберг (1901-1976), М.Планк (1858-1947), В.Паули (1900-1958), Э.Шредингер (1887-1961), и многие другие.
Первой важной вехой в ее становлении стала квантовая гипотеза Планка-Эйнштейна: свет излучается, распространяется и поглощается квантами, энергия которых определяется выражением
E = hn,
где n - частота излучения, h= 6,62*10-34 Дж*с - постоянная Планка.
Сочетание этой гипотезы с методами классической науки позволило построить непротиворечивую теорию фотоэффекта и объяснить закономерности в спектрах нагретых тел.
Вторым важным моментом в становлении новой физики стала теория атома водорода, разработанная датским физиком Н.Бором. Принятая в начале века планетарная модель представляла атом водорода как систему, состоящую из тяжелого ядра и вращающегося вокруг него легкого электрона. Как известно из механики, любая частица, движущаяся по круговой траектории с постоянной скоростью, обладает центростремительным ускорением. В то же время, исходя из электромагнитной теории Максвелла, заряд, движущийся ускоренно, должен излучать энергию. Из-за потери энергии радиус его орбиты должен уменьшаться, а траектория движения иметь вид спирали. Через промежуток времени ~10-9с электрон упадет на ядро, и атом как самостоятельная химическая единица перестанет существовать. Однако большинство химических элементов стабильно, благодаря чему и существуют устойчивые неорганические и органические соединения, планеты, строения и сооружения, разнообразные биологические формы и сам человек. Кроме того, при движении электрона по спирали его излучение должно было бы иметь сплошной спектр. Наблюдаемые же в эксперименте спектры атомов дискретны и представляют серии узких спектральных линий. Для преодоления этих противоречий Бору пришлось ввести два постулата и понятия «стационарная орбита» и «стационарное состояние», существование которых подтвердили проведенные в 1913 году опыты Франка и Герца:
- Большую часть времени электроны в атомах находятся на стационарных орбитах, при движении по которым они не излучают и не поглощают энергии.
- Излучение или поглощение происходит при переходе электрона с одной стационарной орбиты на другую, при этом выполняется условие:
n=(E2-E1)/h,
где Е2 и Е1, соответственно энергии стационарных состояний.
Для построения непротиворечивой теории спектра атома водорода достаточно было знать законы квантования энергий, моментов количества движения и правила, разрешающие тот или иной переход (правила отбора). Однако для построения теории излучения многоэлектронных атомов этого оказалось недостаточно. Необходимо было знать, какие законы управляют распределением электронов по энергетическим состояниям. Понимание этого пришло лишь после открытия спина электрона (англ. spin - вращение, собственный момент количества движения микрочастицы) - собственного механического и магнитного моментов и законов их квантования. Это позволило охарактеризовать состояние электронов в атоме с помощью набора квантовых чисел (n - главное, l- орбитальное, m - магнитное и s - спиновое), определяющих возможные дискретные (квантованные) значения энергии, орбитального и спиновых моментов, а также найти распределение электронов в атоме по стационарным орбитам (или уровням).
В 1925 году швейцарский физик-теоретик В.Паули обосновал принцип: в любой квантовой системе два или более электрона не могут одновременно находиться в одном и том же квантовом состоянии (т.е. иметь одинаковые все четыре квантовых числа). Это фундаментальный закон природы, ему подчиняются все частицы с полуцелым спином, к которым относится электрон. (Частицы с нулевым или целым спином - фотоны, мезоны и др. этому принципу не подчиняются.). Совместное действие закона минимума энергии и принципа Паули определяет закономерности заполнения электронных оболочек атомов, периодичность их свойств, валентность и реакционную способность.
Формирование новых представлений о природе корпускулярно - волнового дуализма завершило подготовительный этап в развитии квантовой физики. В 1924 году французский физик Луи де Бройль пришел к мысли о том, что сочетание волновых и корпускулярных свойств является фундаментальным свойством материи и присуще не только излучению (полю), но и веществу. С любым движущимся материальным объектом можно сопоставить не только корпускулярные характеристики - координаты в пространстве (т.е. траекторию), энергию, импульс, но и волновые - длину волны или частоту. Для характеристики движущегося объекта могут быть использованы выражения, считавшиеся ранее справедливыми только для фотона:
E = hn; р = E/c; l = h/p = h/mv,
где р- импульс объекта.
Если применить эти выражения к летящему теннисному мячу, то сопоставимая ему длина волны окажется равной 4,6*10-34м. Попробуйте измерить такую длину волны! Никакая даже современная техника (не говоря уж о технике двадцатых годов) не может этого сделать. Поэтому гипотеза де Бройля показалась современникам сумасшедшей даже по сравнению с идеями теории относительности. Электрон, который все считали шарообразной микрочастицей с зарядом 1,6*10-19Кл, оказывается и вовсе не частица, а волна. Он не имеет определенной траектории, как же тогда можно говорить об электронных орбитах?
Разрешение этой парадоксальной ситуации привело Н.Бора к открытию принципа дополнительности:
Ни одна теория не может описать объект столь исчерпывающим образом, чтобы исключить возможность альтернативных подходов. «Несовместимости» с точки зрения классической науки в рамках неклассической не исключают, а дополняют друг друга.
Эти «несовместимости» представляют не реализуемые друг без друга две стороны одной медали.
В 1927 году американскими физиками К.Дэвиссоном и Л.Джермером и независимо от них нашим соотечественником П.С.Тартаковским волновые свойства электронов были обнаружены в эксперименте по дифракции электронов на кристаллических структурах. Экспериментально измеренная длина волны lэ = 1,23*10-10м совпала с большой точностью с рассчитанной по формуле де Бройля. Позднее будут обнаружены волновые свойства и у других микрочастиц.
Дальнейшие исследования в области микромира показали, что затруднения Бора были вовсе не случайными. Дело в том, что он в своей теории попытался объединить необъединяемое: квантование энергии и импульса электрона с представлением о нем как некоем заряженном шарике, движение которого по орбите подчиняется законам классической механики. Построение такого «кентавра» оказалось бесперспективным, но оно стимулировало ученых на пересмотр классических представлений о фундаментальных свойствах материи на уровне микромира. Микрочастицы сами по себе не являются ни корпускулами, ни волнами, ни их симбиозом. Их просто невозможно представить наглядно. Но это не мешает нам использовать условные модели и математические абстракции для объяснения их свойств - массы, спина, энергии, импульса, времени жизни и других. Микрочастицы имеют потенциальную способность проявлять корпускулярные или волновые свойства в зависимости от условий наблюдения. Наблюдая их треки в камере Вильсона, мы можем охарактеризовать корпускулярные свойства микрочастиц. Наблюдая их дифракцию на различных структурах, мы можем охарактеризовать их волновые свойства.
Исторически первой квантовой теорией была матричная механика немецкого физика В.Гейзенберга. Но наиболее широкое распространение для описания микромира получило уравнение австрийского физика-теоретика Э.Шредингера, который, используя гипотезу де Бройля и ряд других соотношений, разработал волновую (квантовую) механику, доказал ее идентичность с матричной механикой Гейзенберга, вывел дифференциальное уравнение, описывающее характер поведения электрона в атоме. При этом ему пришлось ввести так называемую волновую функцию Y = Y(x,y,z, t), физический смысл которой был истолкован позднее немецким физиком М.Борном: квадрат модуля волновой функции IYI2 пропорционален плотности вероятности нахождения частицы в данной точке объема. То есть волны де Бройля - это не волны в классическом смысле, их нельзя представить в виде механических или электромагнитных, это волны вероятности. Уравнение Шредингера имеет вид:
НY(x,y,z, t) = ЕY(x,y,z, t),
где Н - функция, которая в квантовой физике называется «оператор» (преобразователь), Е - «собственное» значение энергии электрона. Волновая функция лишь вероятностно описывает поведение электрона в атоме. Вместо классической орбиты электрона рассматривается своеобразное «электронное облако», плотность которого в пространстве распределяется пропорционально IYI2. Она симметрична по отношению к перестановке так называемых тождественных частиц. При перестановке частиц с полуцелым спином (электронов, протонов) она меняет знак, то есть асимметрична, при перестановке частиц с целым спином - она симметрична. Вид распределения электронной плотности зависит от состояния электрона. В атоме водорода (в основном состоянии) оно имеет вид, приведенный на рис. 7.
IYI2
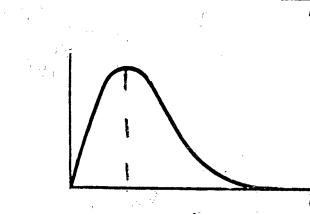
0,59 r, Å
Рис.7 Распределение электронной плотности в атоме водорода (основное состояние)
Максимум электронной плотности приходится на область, соответствующую радиусу первой боровской орбиты, а нахождение электрона внутри сферы радиусом r=0,59Å (1Å=10-10м) является наиболее вероятным. У более сложных атомов оно существенно отличается от приведенного, а форма электронного облака - от сферической.
Вероятностная трактовка волновой функции отражает присущие микрочастицам элементы случайного в их поведении. Это значит, что предсказания в квантовой механике, в отличие от классической, имеют вероятностный характер, а случайность поведения присуща не только коллективу частиц, но и одной, отдельно взятой частице.
Эта специфика проявляется в фундаментальном законе, открытом в 1927 году Гейзенбергом - соотношениях неопределенностей, смысл которых заключается в том, что
невозможно одновременно с одинаковой точностью определить координату и импульс (скорость) или энергию и время взаимодействия частиц:
Dp*Dx ³ h/2p,
DЕ*Dt ³ h/2p,
где величина D и отражает неопределенность (погрешность) в определении характеристики микрочастицы. Исходя из него, необходимо учитывать, что величины координат и импульсов (или энергии и времени взаимодействия) сосредоточены в некоторой области значений Dp и Dх, в которой распределены по вероятностному закону. Это утверждение имеет еще одно название - принцип неопределенности.
Несмотря на то, что все законы микромира носят вероятностный характер и могут быть сформулированы только на языке распределений, они очень точно предсказывают течение ядерных процессов и их результат.
Рассматривая вероятностный характер поведения микрочастиц, современная наука пришла к выводу, что именно статистические, а не динамические закономерности являются фундаментальными. Это значит, что фундаментальность динамических закономерностей проявляется только в рамках механической картины мира. Законы сохранения не отменяют вероятностной природы процессов, они лишь формируют условия, при которых вероятность протекания определенных процессов равна нулю. Например, сохранение массы, импульса, энергии, заряда и других величин жестко выполняется только в закрытых системах. В квантовой механике яркой иллюстрацией этому являются правила запрета для энергетических переходов (правила отбора). Правила отбора и свойства объектов определяют характер спектров в радиоволновой, оптической и рентгеновской областях шкалы электромагнитных волн.
Применение принципа неопределенности к квантовым системам позволило объяснить такие необъяснимые с точки зрения классической физики явления, как туннельный эффект (просачивание a-частиц сквозь потенциальный барьер) и ряд других. Более того, философское осмысление этого принципа показало, что случайность и неопределенность есть фундаментальное свойство природы и присуще всему, начиная от элементарных частиц до одухотворенной деятельности человека.
Гейзенберг первым поставил вопрос о влиянии наблюдателя, приборов и условий на производимый эксперимент, полученные в его ходе результаты и их интерпретацию. Если классическая физика понимает роль экспериментатора как стороннего наблюдателя, то в квантовой механике он является составной частью системы, в которой наблюдается явление, и принципиально неотделим от объекта наблюдения. Он не просто «созерцатель» событий, происходящих в исследуемой системе, он их активный участник. Используя измерительные приборы, он, пусть и незначительно, но вмешивается в ход протекающих событий. И не учитывать этого нельзя.
В процессе становления квантовой механики удалось установить некоторые фундаментальные принципы, отражающие закономерности природы и принципы, позволяющие найти соотношения между новой и старой картинами мира (принцип дополнительности, принцип соответствия, принцип неопределенности и др.). Квантовая механика смогла объяснить электронную структуру химических элементов и спектральные закономерности, обосновать периодическую систему, построить теорию химической связи, стать базой для развития квантовой химии и фотохимии. Под ее влиянием сформировались новые направления синтетической химии, сложились новые представления о строении жизненно важных биополимеров и их метаболизме (греч. metabole - перемена, превращение) в живых организмах. Она подвела к пониманию принципиального отсутствия абсолютного знания и внешнего абсолютного наблюдателя, к признанию его частью развивающейся системы, и существенно повлияла на представление о причинно-следственных связях, заложенное в классическом детерминизме.
Рождение квантовой механики было сложным и трудным. Ее понятия, представления и абстракции нелегко давались и самим ученым. Об этом свидетельствуют их собственные многочисленные воспоминания о том, как мучительно шел процесс становления знаний, поисков философских обоснований теории и смены мировоззрения. Планк, выдвинувший квантовую гипотезу, до конца жизни тяготился ею и пытался искать компромиссные варианты. Эйнштейн, сомневаясь в вероятностном характере поведения микрочастиц, утверждал: «бог не играет в кости», Шредингер, получивший свое знаменитое уравнение, поначалу затруднялся объяснить физическую суть волновой функции. Гейзенберг до последних дней пытался найти «мировую формулу» - уравнение, из которого можно получить весь спектр свойств элементарных частиц.
Вслед за рождением квантовой механики последовал целый каскад принципиальных изменений в других областях естествознания, в основу которых были заложены новые представления о структуре микромира. В химии - это, прежде всего, квантовая химия, в биологии - новый виток в развитии молекулярной биологии и молекулярной генетики. Развитие идей квантовой механики способствовало появлению и развитию новой экспериментальной техники и новых теоретических методов исследования строения вещества (молекулярная, атомная и ядерная спектроскопия, квантовая теория проводимости, нелинейная оптика и т.д.). Благодаря квантовой механике на новую ступень поднялась ядерная физика, что имеет огромное значение для жизни человечества: это возможности использования энергии ядра, поиски путей получения энергии за счет термоядерных реакций. Но у достижений квантовой механики есть и другая сторона. Ее исследования напрямую способствовали разработке ядерного, термоядерного и нейтронного оружия, оружия такой разрушительной силы, которая в один момент способна разрушить мировую цивилизацию.
Дата добавления: 2015-07-12; просмотров: 92 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Релятивистская картина мира | | | Строение материи и физика элементарных частиц |