
Читайте также:
|
Образование солей. Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Анион нитроалакана является амбидентным подобно енолят-аниону. Например, при его протонировании может образовываться, кроме нитроалкана, другая таутомерная форма.

Таутомерную форму нитроалкана называю ациформой или нитроновой кислотой, которая в чистом виде не получена. Нитроновая кислота является ОН- кислотой средней силы. Таким образом, нитросоединения следует рассматривать как таутомеры, реагирующие в нитро- и аци-формах.
В обычных условиях концентрация аци-формы ничтожна. Равновесие смещается в правую сторону в щелочной среде вследствие образования солей.

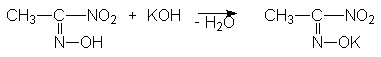
Кристаллические соли щелочных и щелочно-земельных металлов устойчивы и хорошо растворимы в воде. Их иногда называют солями нитроновой кислоты. При подкислении растворов сначала образуется сама нитроновая кислота (ациформа), которая затем изомеризуется в нитроалкан. Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия. Поэтому нитросоединения относят к псевдокислотам. Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, но образуют нейтральные соли щелочных металлов.
Ароматические нитросоединения (нитроарены) - это органические соединения, содержащие функциональную нитрогруппу - NО2, связанную с бензольным кольцом. Нитрогруппа, являясь сильным акцептором электронов как по индуктивному, так и по мезомерному эффектам, сильно дезактивирует ароматическое кольцо по отношению к реакциям ароматического электрофильного замещения. Так, нитробензол не вступает в реакции алкилирования и ацилирования по Фриделю–Крафтсу, и часто используется как растворитель для проведения этих реакций. Естественно, нитроарены не реагируют с солями арилдиазония, азотистой кислотой. В том случае, если реакция электрофильного замещения происходит (бромирование, хлорирование в присутствии кислот Льюиса; нитрование с использованием жестких условий – смеси «дымящей» азотной кислоты и олеума, нитратов с концен- 74 трированной серной кислотой; сульфирование олеумом при высо- кой температуре), то она идет в мета-положение
Ароматические нитросоединенип делятся на две группы: соединения, содержащие нитрогруппу, связанную с атомом углерода ароматического ядра, и соединения, содержащие нитрогруппу в боковой цепи:

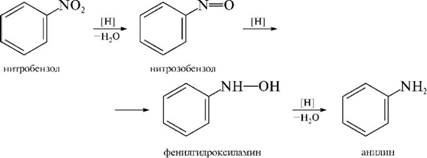
Реакция восстановления (реакция Зинина). При восстановлении ароматических нитросоединений образуются ароматические амины.

12. Амины: строение, изомерия, номенклатура. Основность, реакции с кислотами. Алкилирование и ацилирование. Четвертичные аммониевые соли и основания: строение, свойства. Особенности реакций электрофильного замещения в ароматических аминах. Реакции аминов с азотистой кислотой. Диазосоединения.
Амины – соединения, являющиеся производными аммиака, отличающиеся от него тем, что один, два или все три атома водорода заменяются алкильными или арильными заместителями, что соответствует первичным, вторичным или третичным аминам.

Названия аминов образуют, добавляя к слову амин названия связанных с атомом азота углеводородных радикалов.

В другом варианте номенклатуры за основу названия принимают название родоначальной структуры (самой длинной углеродной цепи, непосредственно связанной с атомом азота) с добавлением суффикса “амин”.

В этом случае вторичные и третичные амины называют как N-замещенные производные первичных аминов.

Если молекула содержит другие функциональные группы, обозначаемые в суффиксе, то аминогруппу обозначают префиксом “амино”.

Названия диаминов образуют от названий соответствующих двухвалентных радикалов или названия родоначальной структуры с добавлением суффикса “диамин”.
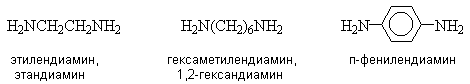
Многие ароматические амины имеют тривиальные названия.

Циклические амины называют, используя номенклатуру гетероциклических соединений или, добавляя к названию двухвалентного углеводородного радикала суффикс “имин”.
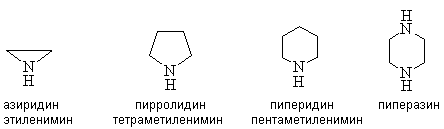
Для аминов характерна изометрия углеродного скелета, изомерия положения аминогруппы и изомерия между первичными, вторичными и третичными аминами.
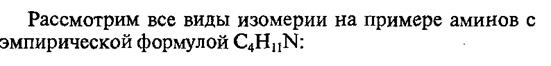


Амины являются основаниями, так как атом азота может предоставлять электронную пару для образования связи с электроннедостаточными частицами по донорно-акцепторному механизму (соответствие определению основности по Льюису). Поэтому амины, так же как и аммиак, способны взаимодействовать с кислотами и водой, присоединяя протон с образованием соответствующих аммониевых солей.

Аммониевые соли хорошо растворимы в воде, но плохо растворяются в органических растворителях. Водные растворы аминов обладают щелочной реакцией:

Основные свойства аминов зависят от природы заместителей. В частности, ароматические амины — более слабые основания, чем алифатические, т.к. свободная электронная пара азота вступает в сопряжение с p-системой ароматического ядра, что уменьшает электронную плотность на атоме азота (-М-эффект). Напротив, алкильная группа является хорошим донором электронной плотности (+I-эффект).
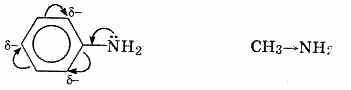


Ацилирование аминов до амидов карбоновых кислот осуществляют такими производными карбоновых кислот, как галогенангидриды и ангидриды. Например, взаимодействием пропиламина с бензоилхлоридом в присутствии щелочи получают Ν-пропиламид бензойной кислоты (Ν-пропилбензамид), а реакция анилина с ангидридом уксусной кислоты приводит к Ν-фенилацетамиду.

Четвертичные аммониевые соли и основания представляют собой производные иона аммония, в котором все четыре атома водорода замещены на радикалы, например [(C2H5)4N]+Cl- (хлорид тетраэтиламмония).
Четвертичное аммониевое соединение вида [R4 N ]+ Cl - является органическим аналогом аммониевой соли.
Третичные амины присоединяют галоидные алкилы, особенно легко иодистые, а также средние эфиры сильных минеральных кислот, образуя соединения, имеющие строение солей четырехзамещенного аммония (соли четвертичных аммониевых оснований), например:
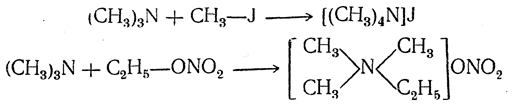
Эти соли растворимы в воде, на лакмус нейтральны, сильно диссоциированы электролитически в водных растворах и легко вступают в реакции обменного разложения с другими солями, например:

При нагревании эти соли распадаются на третичный амин и галоидный алкил (или эфир минеральной кислоты).
Прибавлением к растворам этих солей едкой щелочи нельзя выделить соответствующего основания вследствие обратимости реакции:

В противоположность одно-, двух- и трехзамещенным аммониевым основаниям четырехзамещенные аммониевые основания обладают чрезвычайно сильными основными свойствами, приближаясь в этом отношении к едким щелочам. Эти основания нестойки к нагреванию. Гидроокись тетраметиламмония при нагревании распадается на триметиламин и метиловый спирт:
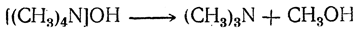
При нагревании всех четвертичных оснований, содержащих высшие алкилы, образуется не спирт, а соответствующий этиленовый углеводород и вода, например:

Дата добавления: 2015-08-27; просмотров: 549 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства нитросоединений | | | Особенности реакций электрофильного замещения в ароматических аминах. |