
Читайте также:
|
1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов). Спирты, как известно, обладают чрезвычайно слабыми кислотными. Однако атом водорода гидроксильной группы, обладая некоторой подвижностью, способен обмениваться в реакциях замещения на активные металлы:
2C2H5OH + 2Na = 2C2H5ONa + H2
этилат
натрия
Образующиеся продукты называют алкоголятами (от названия спиртов — алкоголи). Алкоголяты метилового спирта называются метилатами, а этилового — этилатами и т.д. Алкоголяты — твердые, неустойчивые вещества, легко подвергающиеся гидролизу:
C2H5ONa + H2O = C2H5OH + NaOH
Алкоголяты щелочных металлов обладают более сильными основными свойствами, чем гидроксиды щелочных металлов.
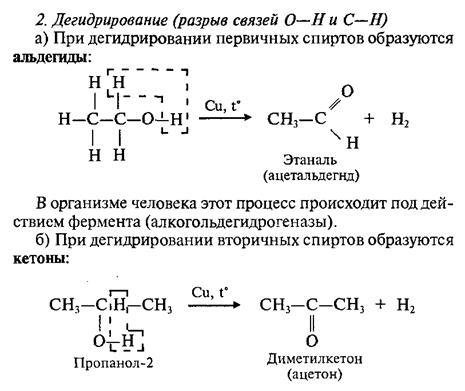
2. Образование простых эфиров.
Взаимодействием алкоголятов с галогеналкилами можно получить простые эфиры:
C2H5—ONa + I—C2H5 = C2H5—O—C2H5 + NaI
диэтиловый
эфир





Основность спиртов (отщепление -OH-группы).
Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону. Неудивительно, что спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.).
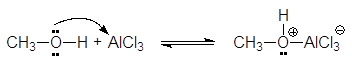
Спирты являются слабыми основаниями (акцепторами протона) за счет неподеленной электронной пары атома кислорода. Поэтому в присутствии сильной минеральной кислоты происходит протонирование спирта (образование донорно-акцепторной связи Н-О):


Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.
Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.

метилгидроксоний хлорид
Кислоты Люиса образуют со спиртами доноро-акцепторные комплексы, в которых атом кислорода является донором неподеленной электронной пары.
 (32)
(32)
В общем, спирты являются сравнительно слабыми основаниями
Дата добавления: 2015-08-27; просмотров: 102 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Спирты. Строение, изомерия, номенклатура спиртов. Химические свойства. Образование алкоголятов, их строение и свойства. Основность и нуклеофильность спиртов. | | | Нуклеофильность спиртов. |