
|
Читайте также: |
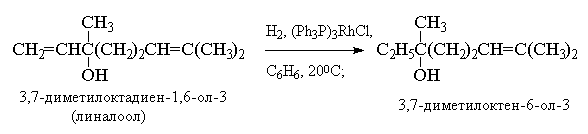
Следует различать гетерогенное и гомогенное каталитическое гидрирование алкенов. В гетерогенном гидрировании используются тонкоизмельченные металлические катализаторы - платина, палладий, рутений, родий, осмий и никель либо в чистом виде, либо нанесенные на инертные носители - BaSO4, CaCO3, активированный уголь, Al2O3 и т. д. Все они нерастворимы в органических средах и действуют как гетерогенные катализаторы. Наибольшую активность среди них проявляют рутений и родий, но наибольшее распространение получил платина и никель. Платину обычно применяют в виде черного диоксида PtO2, широко известного под названием "катализатора Адамса". Другие более активные металлы платиновой группы используют на инертных носителях, например, Pd/C или Pd/BaSO4, Ru/Al2O3; Rh/C и др. Палладий, нанесенный на уголь, катализирует гидрирование алкенов до алканов в спиртовом растворе при 0-200С и нормальном давлении. Никель обычно используется в виде так называемого "никеля Ренея".
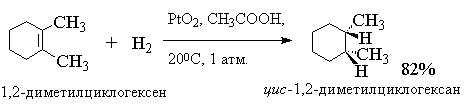
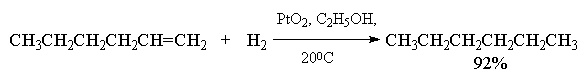
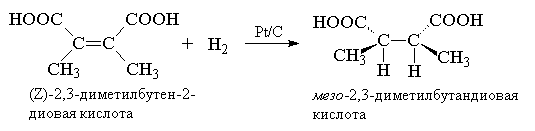
Двойная связь в алкенах гидрируется с большей скоростью по сравнению со многими другими функциональными группами (С=О, COOR, CN и др.) и поэтому гидрирование двойной связи С=С часто представляет собой селективный процесс, если гидрирование ведется в мягких условиях (0-200С и при атмосферном давлении).
Гетерогенное гидрирование на поверхности металлических катализаторов имеет ряд существенных недостатков, таких, как изомеризация алкенов и расщепление одинарных углерод-углеродных связей (гидрогенолиз). Гомогенное гидрирование лишено этих недостатков. Лучшими катализаторами гомогенного гидрирования являются комплексы хлоридов родия (I) и рутения (III) с трифенилфосфином - трис(трифенилфосфин)родийхлорид (Ph3P)3RhCl (катализатор Уилкинсона) и гидрохлорид трис(трифенилфосфин)рутения (Ph3P)3RuHCl.
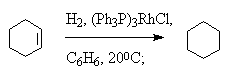
Важное преимущество гомогенных катализаторов заключается в возможности селективного восстановления моно- или дизамещенной двойной связи в присутствии три- и тетразамещенной двойной связи из-за больших различий в скорости их гидрирования.
Алкины. Реакции алкинов. СН-кислотность. Ацетилениды, строение и свойства. Реакции электрофильного и нуклеофильного присоединения, их механизмы. Окисление, восстановление, гидрирование алкинов.
Алкины (ацетилены). Углеводороды, содержащие одну тройную углерод-углеродную связь, в открытой цепи называются алкинами или ацетиленами. Общая и брутто формула СnН2n-2. Первый представитель СНºСН (этин - ацетилен).
По сравнению с алкенами алкины несколько менее активны в реакциях электрофильного присоединения и более активны в реакциях с нуклеофилами, например, с аминами и алкоголятами. Тем не менее, алкины, как и алкены, легче реагируют с электрофильными реагентами, чем с нуклеофильными. Большое влияние на соотношение скоростей реакций алкенов и алкинов оказывает природа растворителей.
В состоянии sp-гибридизации атом углерода обладает наибольшей электроорицательностью, это приводит к сильной C-H кислотности концевых ацетиленовых группировок. Атом водорода, находящийся при углероде тройной связи обладает большей кислотностью, чем атом водорода алкенов и алканов. Объясняется это тем, что атомы С сильнее притягивают электроны, поэтому С-Н связи поляризованы и электроположительные атомы водорода в них проявляют большую кислотность. Кислотность ацетилена и a-алкинов проявляется в следующих реакциях:
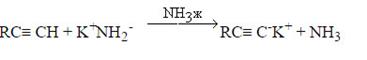
Амид-анион обладает высокой основностью, что обусловливает сдвиг равновесия в сторону образования ацетиленида. В то же время, вода, обладая более высокой кислотностью по сравнению с ацетиленом, вытесняет последний из ацетиленидов: 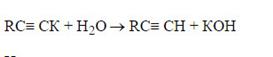
Натриевые, калиевые и другие ацетилениды щелочных металлов являются истинными солями, состоящие из катиона металла и ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные соединения, нерастворимые в воде. Они осаждаются из водного раствора.
1. Гидрирование. Водород присоединяется к тройной связи в присутствии тех же катализаторов, что и к двойной:
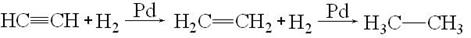
2. Галогенирование. Присоединение хлора, брома и иода к алкинам по электрофильному механизму также идет с меньшей скоростью, чем к алкенам. Образующиеся при этом транс-дигалогеналкены легко выделяются, так как дальнейшее присоединение галогена (кроме хлора) идет с большим трудом:
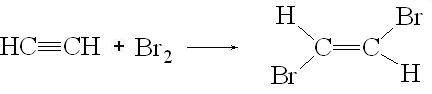
3. Гидрогалогенирование. Галогеноводороды присоединяются к алкинам по электрофильному механизму. Например при присоединении хлороводорода к ацетилену последовательно получается хлорвинил и 1,1-дихлорэтан. Присоединение галогенов и галогеноводородов к алкинам может проходить по радикальному механизму. При электрофильном присоединении соблюдается правило Марковникова, при радикальном механизме наблюдается противоположное направление присоединения.
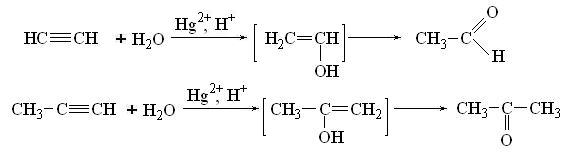
4. Гидратация. Присоединение воды происходит в присутствии сульфата ртути (реакция Кучерова), или над гетерогенными катализаторами, при этом из ацетилена получается уксусный альдегид, а из других ацетиленовых углеводородов - кетоны вследствии перегруппировки образующихся енолов:
5. Присоединение спиртов. Присоединение спиртов в присутствии алкоголятов - это реакция нуклеофилыюго присоединения. В результате образуются виниловые эфиры и ацетали:
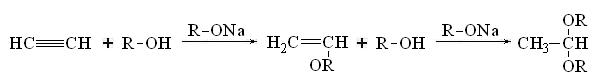
6. Присоединение HCN. Циановодородная кислота присоединяется к ацетилену в присутствии солей меди (I), в результате образуется нитрил акриловой кислоты (акрилонитрил):
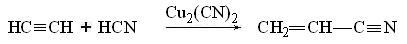
Дата добавления: 2015-08-27; просмотров: 413 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Аллильное замещение галогенами. | | | Окисление. |