
Читайте также:
|
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
К равновесным системам следует отнести также и систему труднорастворимый электролит – его насыщенный раствор. В этом случае мы имеем дело с динамическим гетерогенным равновесием 

|
В этом растворе концентрация ионов очень мала и вследствие этого взаимодействие их друг с другом практически отсутствует.
Константу равновесия для гетерогенной системы можно записать так:

|
концентрацию твердой фазы AgClk можно считать постоянной, тогда

|
С другой стороны,

|
Так как  ,
,  и
и  – постоянные величины, то
– постоянные величины, то

|
В общем виде для уравнения
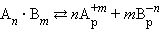
|
|
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов.
В общем виде растворимость L труднорастворимого электролита A n B m определяется соотношением
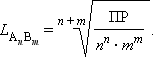
|
Изотерма Вант-Гоффа для процесса растворения

|
имеет вид

|
где 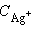 и
и  – неравновесные концентрации.
– неравновесные концентрации.
В состоянии равновесия (Δ G = 0)

|
Тогда для изотермы имеем
|
ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии.
Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре:
1. Если ПК = ПР, Δ G = 0 – система находится в состоянии равновесия (раствор насыщенный).
2. Если ПК <ПР, Δ G < 0 – самопроизвольно протекает процесс растворения осадка.
3. Если ПК >ПР, Δ G > 0 – возможен только обратный процесс – выпадение осадка.
Дата добавления: 2015-08-17; просмотров: 124 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Понятия электродного потенциала, двойной электрический слой. Водородный электрод, стандартные электродные потенциалы, ряд напряжений металлов. Уравнение Нернста. | | | Последовательность разряда ионов |