
|
Читайте также: |
В случае диссоциации электролитов с многовалентными ионами диссоциация происходит по ступеням, причём для каждой ступени существует собственное значение константы диссоциации.
Пример: Диссоциация многоосновной (щавелевой) кислоты:
I стадия: 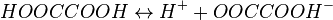
II стадия: 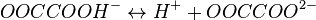
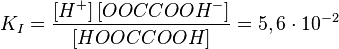
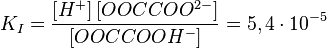
Первая степень диссоциации для таких электролитов всегда много больше последующих, что означает, что диссоциация таких соединений идёт главным образом по первой стадии.
Дата добавления: 2015-08-17; просмотров: 83 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Определение | | | Связь константы диссоциации и степени диссоциации |