
Читайте также:
|
Если система, разделенная мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
БИЛЕТ 14.
1) Свойства ковалентной связи. Направленность связи,  ,
,  ,
, 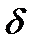 - связи. Структура молекул типа
- связи. Структура молекул типа  ,
,  ,
,  .
.
Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Ковалентная связь направлена в пространстве, что обусловливает пространственную структуру молекул (свойство направленности).
В зависимости от того, какими электронами осуществляются связи – s-, р-, d- или f- электронами, существенно различны энергии связей, длины связей, а также их направление в пространстве.
Электронные облака имеют различную форму, поэтому их взаимное перекрывание осуществляется несколькими способами: различают s- (сигма), p- (пи) и d (дельта)-связи.

s-связь
Если перекрывание электронных облаков происходит вдоль линии, соединяющей ядра – это s-связь; если облака перекрываются вне этой линии, возникают p- и d-связи. Разновидности связи при комбинировании s-, р- и d-орбиталей показаны на рисунках:


p-связь d-связь
Если между атомами возникла одна общая электронная пара (обычно s-связь), такая связь называется одинарной, если две и более, то кратной: двойной, тройной
Изоэлектронные молекулы - молекулы, имеющие равное число электронов (AB) Линейная трехатомная молекула имеет четыре колебательных степени свободы. (А2В)
Плоская треугольная молекула (А3В)
Конечная форма молекулы зависит от типа гибридизации.
2) Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Дата добавления: 2015-08-17; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Повышение температуры кипения растворов | | | Классическая теория электролитической диссоциации |