
|
Читайте также: |
Задача № 279.
Как рассчитывается и какой физико-химически смысл имеет произведение растворимости вещества? при 20  растворимость идиода свинца (II) равна 6,5*10-4 моль/л. Вычислить произведение растворимости этого вещества.
растворимость идиода свинца (II) равна 6,5*10-4 моль/л. Вычислить произведение растворимости этого вещества.
Решение:
Произведение растворимости вещества легко найти, зная его растворимость, если растворимость
(S)PbJ2 = 6,5 * 10-4 моль/л(при t=20  ), это значит что в 1 литре насыщенного раствора содержится 6,5*10-4 моль Pb2+ и (6,5 * 10-4)*2моль J-, следовательно:
), это значит что в 1 литре насыщенного раствора содержится 6,5*10-4 моль Pb2+ и (6,5 * 10-4)*2моль J-, следовательно:
ПPPbJ2=[Pb2+][J-]=S*(2S)2 =4S3=4*(6,5 * 10-4)3=10-9.
Глава 14. Ионные реакции и гидролиз солей.
Задача №292.
Объяснить механизм гидролиза, учитывая, что в водном растворе содержатся гидратированные ионы. За счет образования и разрыва каких связей идет процесс гидролиза? Написать молекулярное и ионное уравнения гидролиза данных солей, указать в каждом случае тип и характер среды раствора: KNO2, Na2CO3, Fe(NO3)3.
Решение:

 KNO2+H2O KOH+NHO2
KNO2+H2O KOH+NHO2

 и.н (ионное полное) K+ + NO2 -+ H2O K+ + OH- +HNO2
и.н (ионное полное) K+ + NO2 -+ H2O K+ + OH- +HNO2

 и.с (сокращенное) NO2-+H2O OH- + HNO2 pH
и.с (сокращенное) NO2-+H2O OH- + HNO2 pH 
данный гидролиз идет по аниону соли, так как HNO2 - соль образованная слабой кислотой и сильным основанием.

 Na2CO3 + 2H2O 2NaOH+H2CO3
Na2CO3 + 2H2O 2NaOH+H2CO3

 и.п (ионное полное) 2Na+ +CO32- + 2H2O 2Na+ + 2OH- + H2CO3
и.п (ионное полное) 2Na+ +CO32- + 2H2O 2Na+ + 2OH- + H2CO3

 и.с (сокращенное) CO32- + 2H2O 2OH- + HCO3 pH
и.с (сокращенное) CO32- + 2H2O 2OH- + HCO3 pH 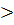 7
7
данный гидролиз идет по аниону, так как соль Na2CO3 образована сильным основание и слабой кислотой.

 Fe(NO3)3 +3H2O Fe(OH)3 + 3HNO3
Fe(NO3)3 +3H2O Fe(OH)3 + 3HNO3

 и.п (полное) Fe3+ + 3N
и.п (полное) Fe3+ + 3N  +3H2O Fe(OH)3 + 3H+ + 3N
+3H2O Fe(OH)3 + 3H+ + 3N 

 и.с (сокращенное) Fe3+ + 3H2O Fe(OH)3+ 3H+ pH
и.с (сокращенное) Fe3+ + 3H2O Fe(OH)3+ 3H+ pH 
гидролиз идет по катиону, так как данная соль Fe(NO3)3 образована сильной кислотой и слабым основанием.
Дата добавления: 2015-08-17; просмотров: 205 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 11. Концентрация растворов. | | | Глава 1. Введение в неорганическую химию. |