
Читайте также:
|
Задача № 67.
Для каждой окислительно-восстановительной реакции определить ее тип; указать восстановитель и окислитель; подобрать коэффициенты методом электронного баланса и методом полуреакций.
Решение:
а) 6FeSO4+K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
1) тип: межмолекулярное ОВ
2)восстановитель-FeSO4, окислитель- K2Cr2O7

 3) баланс:
3) баланс: 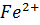 -1
-1  =
= 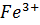 3
3
 +3
+3  =
= 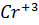 1
1

 4) полуреакции:
4) полуреакции: 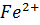 =
= 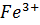 -
- 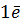
Cr2O72- +14 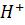 +6
+6  =2
=2 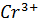 +7H2O 6
+7H2O 6
6 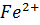 +
+ 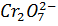 +14
+14 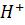 =6
=6 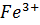 +2
+2 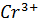 +7H2O 1
+7H2O 1
5) MЭFeSO4 = 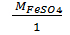 = 152 г/моль;
= 152 г/моль;
 FeSO4 =
FeSO4 = 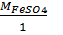 = 152г/моль;
= 152г/моль;
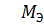 K2Cr2O7 =
K2Cr2O7 = 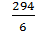 = 49 г/моль.
= 49 г/моль.
б)  2BiCl3+3SnCl2+12KOH=2Bi+3K2SnO3+6KCl+6H2O
2BiCl3+3SnCl2+12KOH=2Bi+3K2SnO3+6KCl+6H2O
1) тип: межмолекулярное ОВ
2) окислитель-BiCl3, восстановитель- SnCl2

 3) баланс: Bi3+ + 3
3) баланс: Bi3+ + 3  =Bi0 2
=Bi0 2
6
Sn2+-2 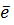 = Sn+4
= Sn+4
4)полуреакции: Bi3++3  =Bi0
=Bi0

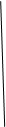 Sn2++6O
Sn2++6O 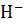 =Sn
=Sn 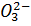 +3H2O+2
+3H2O+2 
6 2
2Bi3++3Sn2++18O 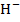 =2Bi0-6
=2Bi0-6  +3SnO32-+9H2O+6
+3SnO32-+9H2O+6 
5) MэBiCl3 = 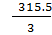 =105.167г/моль;
=105.167г/моль;
MэSnCl2 + 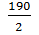 = 95г/моль
= 95г/моль
в) 4H2O2+3H2S=H2SO4+4H2O
1) тип: межмолекулярное ОВ
2) окислитель-H2O2, восстановитель-H2S

 3)баланс: O- +1
3)баланс: O- +1  O2-
O2-
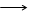 S2- - 8
S2- - 8  S+6
S+6

 4) полуреакции: H2O2+2H++2
4) полуреакции: H2O2+2H++2  =2H2O
=2H2O
S2-+4H2O=SO42-+8H++8 
8 1
4H2O2+8H++8  +S2-+4H2O=8H2O+SO42-+8H++8
+S2-+4H2O=8H2O+SO42-+8H++8 
5) MЭH2O2 = 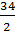 = 17г/моль;
= 17г/моль;
MЭH2S = 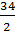 = 4.25г/моль.
= 4.25г/моль.
Глава 5. Химическая связь и строение молекул.
Задача № 100.
Чем объясняется способность многих элементов к образованию числа связей, превышающего число неспаренных электронов в их атомах? Какое состояние атома называют основным и возбужденным? В основном или возбужденном состоянии находятся атомы фосфора и серы при образовании молекул PCl3 и PCl5, H2S и SO3?
Решение:
Способность многих элементов к образованию числа связей, превышающих количество неспаренных электронов объясняется тем, что неспаренные электроны способны распариваться на другие орбитали.
Основное состояние атома соответствует наиболее устойчивому состоянию электрона в этом атоме при котором значение его энергии минимально. Любое другое состояние называется возбужденным.
 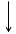
| 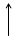
| 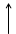
|
S+16 1S22S22P63S23P3 3P
В невозбужденном состоянии сера будет проявлять валентность II.
H2S содержит серу в валентности II, поэтому, сера в основном состоянии, SO3 содержит серу в валентности VI, значит, сера в возбужденном состоянии:
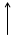
| 
| 
|
P+15 1S22S22P63S23P3 3P
В=III
PCl3 содержит фосфор в валентности III, следовательно, PCl3 содержит фосфор в невозбужденном состоянии, PCl5 , содержит P в валентности (5) –это возбужденное состояние фосфора.
Дата добавления: 2015-08-17; просмотров: 204 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Глава 1. Атомно-молекулярное учение. | | | Глава № 7. Основы химической термодинамики. |