
|
Читайте также: |
Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением
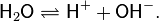
Константа диссоциации воды при 25 °C составляет
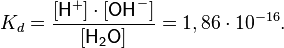
Считая, что в большинстве растворов вода находится в молекулярном виде (концентрация ионов H+ и OH− мала), и учитывая, что молярная масса воды составляет 18,0153 г/моль, а плотность при температуре 25 °C — 997,07 г/л, чистой воде соответствует концентрация [H2O] = 55,346 моль/л. Поэтому предыдущее уравнение можно переписать в виде
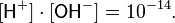
Эта величина называется ионным произведением воды. Так как для чистой воды [H+] = [OH−], можно записать

Водородный показатель воды, таким образом, равен
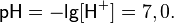
Дата добавления: 2015-08-17; просмотров: 59 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Связь константы диссоциации и степени диссоциации | | | Диссоциация слабой кислоты |